阿霉素促进过表达GSDME 的乳腺癌MDA-MB-231 细胞发生焦亡
黄晓莹, 唐振宁, 刘奇伦
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院肿瘤医院肿瘤外三科,银川 750004)
乳腺癌是最常见的女性恶性肿瘤之一,是全球女性第一大癌症死亡原因[1]。细胞焦亡是在细胞凋亡和坏死后发现的一种新的程序性、炎症性细胞死亡形式,它的特征是细胞肿胀,从细胞中吹出大气泡。细胞焦亡作为一种促炎型死亡,可抑制肿瘤的发生、发展。研究[2]表明,细胞焦亡与其相关信号通路中各种炎性介质的释放、肿瘤的发生及其耐药密切相关。
Gasdermin E(GSDME)是Gasdermin 家族的一员,在细胞焦亡和继发性坏死的调控中发挥重要作用。焦亡相关的Caspase-3 在化疗药物、肿瘤坏死因子、病毒感染等激活下可特异性切割GSDME,从而导致细胞焦亡。此外,GSDME 被认为是一种抑癌剂,与结直肠癌、乳腺癌、肝癌和胃癌有关[3]。阿霉素(DOX)是临床常用的化疗药物,有关DOX 处理乳腺癌细胞发生细胞焦亡的研究较少,本课题采用慢病毒转染技术使乳腺癌MDA-MB-231 细胞中GSDME 高表达,探讨DOX处理过表达GSDME 乳腺癌细胞是否促进焦亡发生,以期为研究有抑制细胞焦亡作用的化疗药物提供实验基础。
1 材料与方法
1.1 主要试剂
乳腺癌细胞株MDA-MB-231 购自中国科学院细胞库,一抗购自美国Abcam 公司,DOX 购自美国APExBIO 公司,慢病毒包装由自天津舍为斯科技有限公司完成,抗体购自美国Abcam 公司,细胞凋亡检测试剂盒、CCK-8 法试剂盒购自北京全式金生物技术有限公司,乳酸脱氢酶(LDH)试剂盒购自美国Promega 公司。
1.2 方法
1.2.1 细胞培养 将复苏的乳腺癌细胞加L15培养基(10%胎牛血清、100 IU·mL-1青霉素和100 μg·mL-1链霉素)培养于T25 细胞培养瓶中,37 ℃、5%CO2的湿化培养箱中培养。细胞每2~3 d进行一次传代。
1.2.2 GSDME 的基因克隆 用Trizol 法提取细胞中RNA,检测RNA 的纯度。合成PCR 引物后,逆转录合成cDNA。通过PCR 扩增获取目的基因序列,Ecor I 限制性内切酶酶切并纯化后插入慢病毒表达载体中进行扩增培养。
1.2.3 应用慢病毒转染技术提高乳腺癌MDAMB-231 细胞GSDME 表达 将构建的Vector 质粒和OE-GSDME 转化Ecoli DH5α,挑取单克隆并提取质粒,进行细胞转染,收集足够的慢病毒液,转染前一天将正常培养的细胞弃掉旧培养基,用1 mL 的PBS 溶液洗涤2 次后加入Trypsin液1 mL 放置于37 ℃、5%CO2温箱内消化1 min 后加入培养基终止消化,转移至离心管中,1 000 r·min-1离心5 min;弃上清,收集细胞沉淀,用适量细胞培养液重悬细胞,细胞计数后按2×105个/孔的密度加入六孔板中;将接种细胞的细胞培养板转入CO2培养箱中培养,按照每孔940 μL 的培养基加入20 μL 的病毒液;混匀后将孵育好的混合液加入细胞培养板;12~16 h 后更换新鲜培养基继续培养,72 h 后通过荧光观察感染效率。
1.2.4 Western blot 检测GSDME 过表达 从未经任何处理的空白对照组(MDA-MB-231)、空载体对照组(NC)和转染高表达组(OE-GSDME)各个细胞样本中吸出培养基,用PBS 洗涤细胞并吸净,加入蛋白裂解液刮下细胞;冰浴静置30 min,期间超声破碎处理3 次,以完成细胞充分裂解,4 ℃低温离心机12 000 r·min-1离心15 min,收集上清提取总蛋白。采用BCA 蛋白定量法测定蛋白浓度,加入DTT 缓冲液,恒温金属浴95 ℃煮5 min 使蛋白变性,转膜,用含5%脱脂奶粉的TBST 封闭1 h 后加入一抗,孵育过夜后洗涤加入二抗,在室温下摇床孵育1 h 后显色曝光,使用Image J 软件分析条带的灰度值,每个样本独立实验重复3 次。
1.2.5 CCK-8 法检测DOX 对乳腺癌MDA-MB-231 细胞增殖的影响 根据不同药物浓度进行分组,按照0、2、4、6、8、10、12、14 μg·mL-1的药物浓度处理NC 组和OE-GSDME 组,继续放入CO2培养箱中,培养24 h。细胞经药物处理24 h后,吸除各孔细胞培养上清,PBS 清洗各孔细胞;每孔加入10 μL 的CCK-8 溶液,在细胞培养箱内继续孵育1 h;测定在450 nm 处的吸光度值。
1.2.6 流式检测细胞焦亡 分别收集NC 组和OE-GSDME 组细胞进行流式检测,分别向两组加入DOX,药物处理时间为24 h。用0.25%胰酶消化细胞,1 000 r·min-1离心5 min 收集细胞沉淀;用预冷的PBS 洗涤细胞沉淀2 次,制备成1×106/mL 浓度的细胞悬液;取100 μL 细胞悬液,加入100 μL 凋亡检测Regent;轻柔混匀,室温避光孵育20 min 后进行流式检测。以Annexin V-FITC+/PI+双阳性细胞百分率作为焦亡率[4-8]。
1.2.7 LDH 释放实验 向NC 组和OE-GSDME组分别加入4 μg·mL-1DOX 处理细胞,继续放入CO2培养箱中,培养24 h。设置一个最大LDH 释放组,检测前45 min 加入裂解液,充分裂解细胞,以评估LDH 最大活性;设置培养基孔,作为背景值;24 h 后从每孔中取出50 μL 转移到一个新的96 孔板中。每孔中加入50 μL 底物混合物,避光,室温孵育30 min;每孔中加入50 μL 的终止液,1 h 后测量490 nm 处吸光值;从样品读数中减去背景值;细胞毒性百分比=(实验孔LDH释放的OD490 值/最大LDH 释放的OD490 值)×100% 。
1.3 统计学方法
使用GraphPad Prism 9.12 软件进行数据的统计分析和作图,计量资料组间比较采用t 检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 GSDME 过表达慢病毒高效感染MDA-MB-231 细胞
构建OE-GSDME 慢病毒载体,转染GSDME低表达的乳腺癌细胞MDA-MB-231,可见病毒包装系统中的GFP 发出的绿色荧光,证明慢病毒转染细胞成功,见图1。
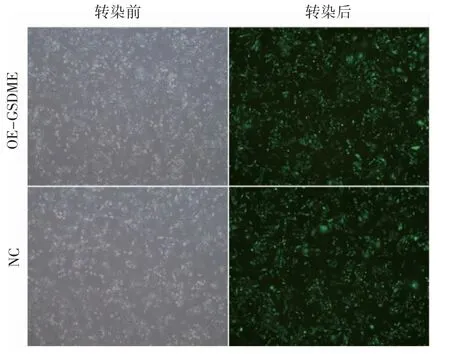
图1 慢病毒转染乳腺癌MDA-MB-231 细胞(×40)
2.2 成功构建GSDME 过表达
Western blot 实验结果显示,OE-GSDME 组GSDME 蛋白的表达量高于MDA-MB-231 和NC组,见图2。
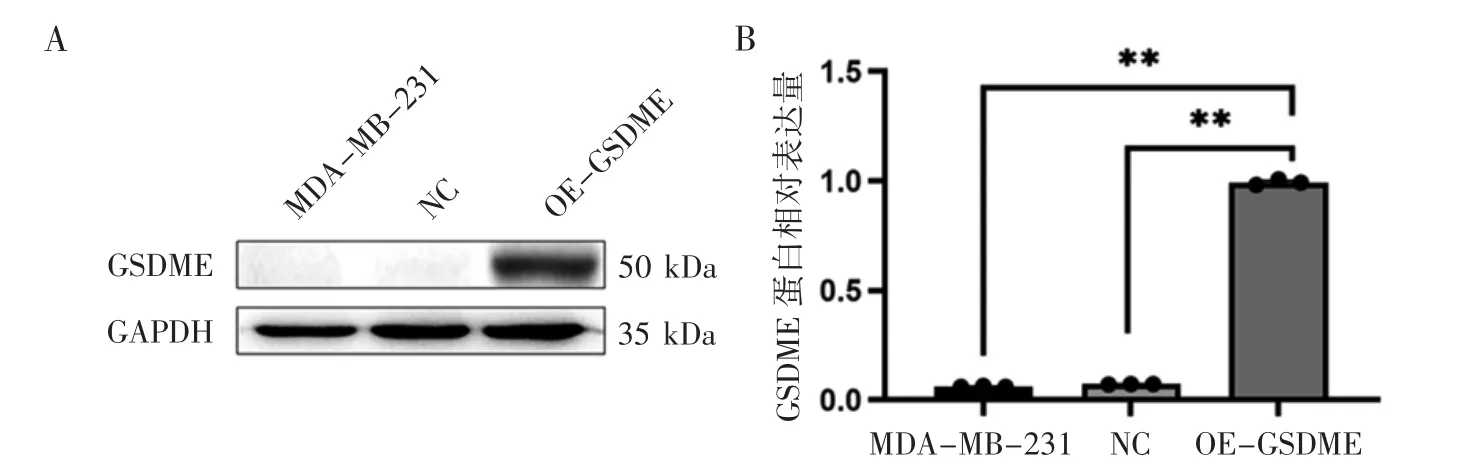
图2 各组GSDME 表达水平比较
2.3 CCK-8 实验筛选药物浓度
结果显示,DOX 处理OE-GSDME 组、NC 组24 h 后的IC50分别为5.1 μmol·mL-1和9.6 μmol·mL-1,见图3。

图3 DOX 干预24 h 后CCK-8 法测定两组细胞存活率
2.4 LDH 检测实验
用约为半数抑制浓度DOX(4 μg·mL-1)分别处理转染细胞和空载体细胞,光镜观察、流式细胞术和LDH 释放水平检测结果显示,流式细胞术结果显示,其中NC 组及OE-GSDME 组未加药时焦亡率分别为8.37%、8.30%,两组间差异无统计学意义(P>0.05);NC+DOX 组焦亡率(17.40%)低于OE-GSDME+DOX 组(39.08%)(P<0.01);OE-GSDME 组LDH 释放率高于NC组(P<0.01),见图4。
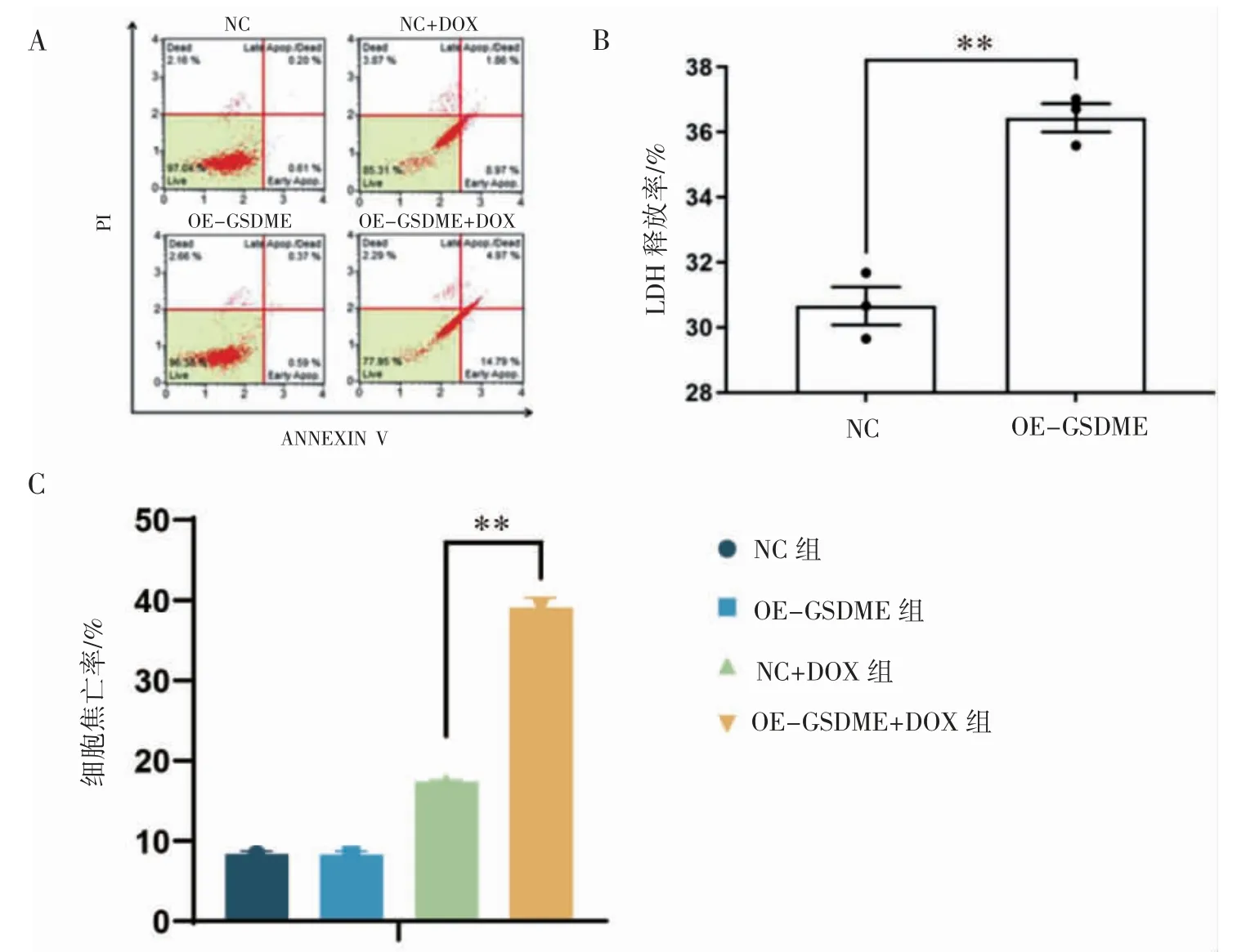
图4 DOX(4 μg·mL-1)干预NC 组和OE-GSDME 组24 h 后流式细胞术和LDH 释放结果
2.5 高倍镜下细胞形态的变化
加入DOX 后细胞发生肿胀,在DOX 的作用下使乳腺癌MDA-MB-231 细胞发生焦亡,见图5。
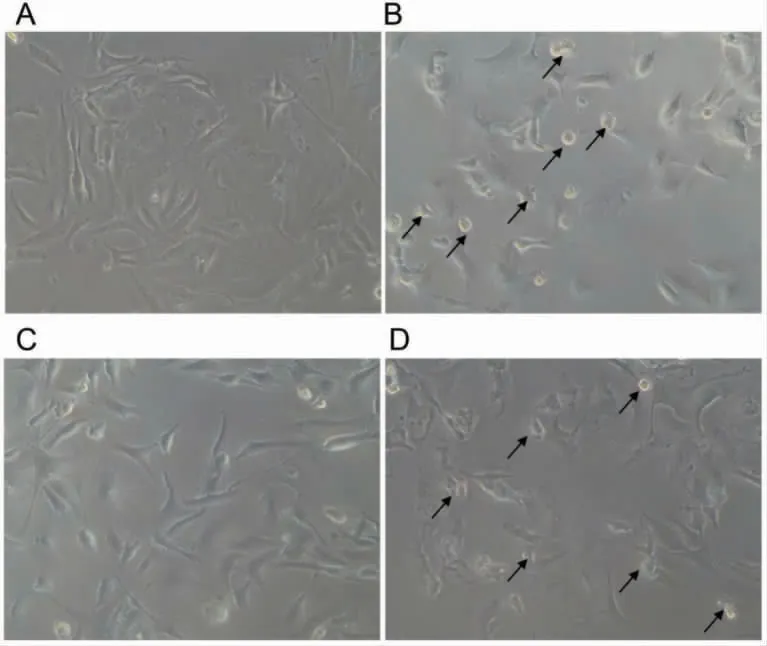
图5 DOX(4 μg·mL-1)干预NC 组和OE-GSDME 组24 h 后显微镜下细胞形态(×200)
3 讨论
Gasdermin 家族蛋白(GSDMs)多表达于胃肠道和皮肤的上皮组织,GSDMs 可能参与了上皮细胞发育、凋亡、炎症、癌变及免疫相关性疾病等多个生理和病理过程[9]。细胞焦亡是一种炎症型细胞溶解的死亡方式,需要Gasdermin 蛋白介导破坏细胞,以细胞的肿胀和溶解释放许多促炎因子为特征。炎性小体、Caspase 和Gasdermin 家族在焦亡中起关键作用。
细胞焦亡与肿瘤的发生、发展及药物治疗肿瘤产生的耐药性密切相关[10]。作为Gasdermin 家族的一员,GSDME 在细胞凋亡和继发性坏死的调控中发挥重要作用[11]。GSDME 的N 端位于外显子2 和6 区域,C 端可以作为调节器通过折叠调节N 端结构域从而诱导细胞凋亡的活性避免细胞凋亡的发生[12]。GSDME 在ER+/腔A 型乳腺癌中的表达主要与单核系和巨噬细胞有关,可能促进人乳腺癌的肿瘤内免疫应答[13]。人类乳腺癌细胞MCF 7 微阵列分析表明,GSDME 启动子区的DNA 甲基化引起GSDME 沉默,去甲基化剂可完全恢复P53 诱导的GSDME 的表达[14]。GSDME甲基化被认为会增加乳腺癌患者淋巴结转移的风险[15]。因此,越来越多的研究关注了GSDME 与肿瘤发生的关系。实验证明,GSDME 通过P53 信号通路促进了依托泊苷诱导细胞凋亡[6]。除此之外,许多抗癌药物通过由BCL 2 家族蛋白控制的线粒体途径诱导癌细胞死亡。BCL 2 家族成员BAK 和BAX 在激活后可在线粒体外膜(MOM)形成孔隙,导致线粒体膜间成分释放,导致Caspase级联激活[16-18]。GSDME 在不同的细胞类型和组织中的表达水平不同。高水平的GSDME 会导致细胞焦亡,而低水平的细胞在化疗后会发生凋亡[19],与本研究结果一致。研究[20]表明,米立酮通过调节ROS/丝裂原激活和细胞外信号调节激酶(MEK)/细胞外调节蛋白激酶1/2(ERK 1/2)途径抑制肝癌细胞的生长,化疗所致的细胞焦亡是由BAK/Bax-Caspase-3-GSDME 途径介导的,而且BAK 或BAX 单独介导了这一过程。更重要的是,GSDME 在化疗所致的细胞焦亡过程中为烷基化,而药物联合可以抑制这一过程[21]。本研究结果显示,顺铂和紫杉醇均能诱导细胞凋亡和细胞焦亡,与紫杉醇相比,顺铂可引起的细胞焦亡更明显,引起Caspase-3 的活化和GSDME-NT 生成水平更高[22]。在NHEK 和HPlEpC 细胞中,敲除GSDME 基因可将化疗药物诱导的细胞焦亡转化为凋亡,从而使化疗药物通过GSDME 介导的焦亡作用而杀死某些正常细胞[23]。大多数癌细胞GSDME表达量低,用脱氧胞苷逆转GSDME 沉默,使细胞对化疗药物敏感[24-26]。因此,GSDME 被认为是一种与多种癌症有关的抑癌剂。
综上所述,DOX 促进过表达GSDME 的乳腺癌细胞发生细胞焦亡,阐明了在乳腺癌中化疗药物DOX 和过表达GSDME 的相关性,进一步研究探明GSDME 介导乳腺癌细胞发生焦亡的机制,对于乳腺癌的治疗以及对于抗乳腺癌相关药物开发具有进一步的指导意义,同时为乳腺癌免疫治疗提供新的靶点奠定了新的研究基础。

