全转录组揭示化合物M6对谷氨酸棒状杆菌基因表达的影响
杨 丽,唐 静,李晓雨,梁 彤,秦闫燕,林 源,杨延辉
(宁夏医科大学基础医学院,宁夏回族自治区常见传染病防治重点实验室,银川 750004)
通过高通量药物筛选获得一类具有显著抗结核作用的[N-(1,3,4- 二唑-2-)苯甲酰胺]化合物(M6),其对MTB H37Rv菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)为0.062 5μg·mL-1。M6结构中含有1,3,4- 二唑杂环,该母核的其他衍生物已经用于抗细菌、抗真菌和抗病毒等药物合成[3-5]。并且M6对敏感和耐药的MTB均具有相似的MIC,与现有的抗结核药物不存在交叉耐药。因此,筛选M6所影响的细菌信号通路,将有可能为开发新型抗结核药物提供候选分子及潜在的药物作用靶点。
本研究展示了M6的分子结构,测定了M6的抗菌谱;选用MTB模式菌谷氨酸棒状杆菌(corynebacterium glutamicum,Cg)和耻垢分枝杆菌(mycobacterium smegmatis,Ms)以确定M6的敏感菌株,用1/2 MIC的化合物M6和相同浓度的二甲基亚砜(dimethyl sulfoxide,DMSO)溶剂处理24 h的Cg,分别作为样品和对照,进行转录组测序;提取Cg样品和对照的总RNA,用Illumina HiseqTM3000高通量测序平台进行RNA-seq测序分析。通过差异表达基因(different expression genes,DEGs)分析、GO功能和KEGG通路及蛋白质互作网络分析,初步筛选显著差异表达的基因,并对筛选的基因进行功能分析,获得M6所影响的主要通路和关键蛋白,以期为深入研究M6的抗菌作用机制提供候选基因。
1 材料与方法
1.1 菌种、培养基及试剂
1.1.1 菌种 Cg ATCC13032和Ms MC2155由中国医学科学院医药生物技术研究所肖春玲研究员惠赠;金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、枯草芽孢杆菌、大肠埃希菌、绿脓杆菌、变形杆菌、肺炎克雷伯杆菌、白色念珠菌和黑曲霉由实验室提供并保存;结核分枝杆菌H37Rv标准株活性检测委托北京市结核病胸部肿瘤研究所完成。
1.1.2 培养基及配方 脑心浸液肉汤培养基(brain heart infusion broth,BHI)、脑心浸液肉汤固体培养基(brain heart infusion broth agar,BHIA)、7H9和7H10均为混合粉剂,根据使用说明加蒸馏水溶解;121℃高压灭菌15 min,常温储存备用。7H9和7H10按照灭菌完成后添加10%OADC(牛血清白蛋白50 g,葡萄糖20 g,NaCl 8.5 g,甘油5 mL,蒸馏水定容至1 L,0.22μm过滤除菌)。LB液体/固体培养基,称取胰蛋白胨(OXOID)10 g、酵母提取物(OXOID)5 g、NaCl 10 g、蒸馏水1 L溶解,固体培养基另加15 g琼脂;121℃高压灭菌15 min,常温储存备用。沙式葡萄糖液体/琼脂培养基,分别称取沙式葡萄糖液体培养基和沙式葡萄糖琼脂培养基50 g和65 g,蒸馏水定容至1 L溶解,锥形瓶分装,121℃高压灭菌15 min,常温储存。
1.1.3 试剂 M6购自北京百灵威科技有限公司,刃天青购自北京博奥拓达科技有限公司。
1.2 方法
1.2.1 化合物M6的抗菌谱测定 取-80℃冻存的各种常见条件致病菌,用BHI和BHIA培养基培养粪肠球菌、金黄色葡萄球菌、表皮葡萄球菌、变形杆菌、肺炎克雷伯杆菌、枯草芽孢杆菌和Cg,37℃培养24~48 h;用LB液体和固体培养基培养大肠杆菌和绿脓杆菌,37℃分别培养12~14 h和24~48 h;7H9和7H10培养Ms MC2155和MTB H37Rv标准株,37℃分别培养48~72 h和1~2周;沙式葡萄糖液体/琼脂培养基培养黑曲霉和白色念珠菌,37℃培养48~72 h。条件致病菌抗菌谱测定详见鲁众阳等[6]的研究。
1.2.2 刃天青法测定M6分别对Cg及Ms的MIC 从-80℃冰箱取Cg及Ms分别涂布于BHIA和7H10培养基,37℃倒置培养16 h和72 h。挑取单克隆分别置于5 mL BHI和7H9(增补10%OADC)培养基中,37℃、200 r·min-1分别培养14 h和72 h;菌液按1∶1 000的比例稀释;取96孔板,B2孔加196μL稀释的Cg菌液,从B3开始到B11、C2到C11每孔加100μL稀释的Cg菌液,E2孔加196μL稀释的Ms菌液,E3到E11、F2到F11每孔加100μL稀释的Ms菌液,B2、E2各加入1 280μg·mL-1的M6共4μL,混合B2、E2后取100μL分别加至B3、E3,按2倍的M6浓度依次稀释;将混匀的96孔板用封口膜封口,将Cg和Ms的96孔板置于37℃培养箱分别培养12 h和48 h后,加入10μL 100μg·mL-1的刃天青溶液,分别继续培养8 h和24 h;酶标仪检测各孔的OD600值,绘制生长曲线并确定MIC值。
1.2.3 RNA-seq测序分析
人还应该懂得自我开发、自我造就。往往自己内在的潜能自己不一定清楚,要靠自己勤奋地学习,扩展自己的知识和兴趣来开发。兴趣是很重要的,同时也是靠学习来加深和扩展的,只要你有兴趣,你就能钻进去,锲而不舍,以至于成功。
1.2.3.1 RNA-seq测序样品制备 取Cg加至5 mL BHI培养基中,37℃、200 r·min-1培养14 h;按照1∶100的比例加Cg菌液至1.2 L新鲜的BHI培养基中,37℃、200 r·min-1培养至对数生长期(OD600=0.5~0.6);把1.2 L的Cg菌液平均分为6份,其中3份分别加入1/2MIC的M6,分别命名为S1、S2、S3,作为实验组,剩余3份加入相同浓度DMSO作为对照组,分别命名为C1、C2、C3。菌液继续培养12 h,5 000 r·min-1离心10 min,收集菌体;1份菌体储存于-80℃冰箱,1份送晶能生物技术(上海)有限公司进行RNA-seq测序。
1.2.3.2 Total RNA的提取和质检 Trizol法提取Total RNA,mRNA测序建库要求RNA总量为2μg;Nano drop(Agilent Technologies,美国)检测RNA纯度(OD260/280比值为1.8~2.2);Qubit 2.0 Flurometer(Life Technologies,美国)精确定量RNA浓度(500 ng·μL-1)。
1.2.3.3 cDNA文库构建 Cg属于原核生物,通过试剂盒去除rRNA进行mRNA富集;对富集的mRNA进行片段化,随机将mRNA打断成200 bp左右的短片段,利用随机引物反转录合成第一链cDNA;利用AMPure XP beads纯化第二链cDNA,由End Repair Mix末端补平,并加A尾和测序接头;利用USER酶消化第二链cDNA,使文库只含第一链cDNA;PCR扩增15个循环得到最终的cDNA文库;为确保cDNA文库构建质量,利用Qubit 2.0和Agilent 2100分别检测cDNA浓度及插入片段大小,q-PCR法定量检测cDNA浓度。利用Illumina测序平台2151测序模式进行全转录组测序。
1.2.4 DEGs筛选 针对所有样本采用StringTie软件统计已知基因的原始序列计数,已知基因的表达量计算采用FPKM计算度量指标(FPKMfragments per kilobase of transcript per million fragments mapped)。针对有重复样本的实验设计,利用DESeq2软件对不同样本组之间筛选差异表达的已知基因,以满足|log2FC|≥1.0和P≤0.05差异表达范围筛选两组之间的差异基因,绘制火山图。
1.2.5 差异表达基因GO和KEGG功能分析 采用Top GO软件进行GO功能分析,对差异表达基因进行功能注释和归类,实现目标基因的功能富集。KEGG通路分析针对差异基因进行KEGG数据库中通路的功能注释和归类,KEGG通路富集分析与GO功能富集分析类似[7]。
1.2.6 DEGs蛋白质相互作用网络分析 利用STRING蛋白质相互作用在线数据库(http://string-db.org)查询和下载该物种的蛋白质相互作用网络,构建差异表达基因蛋白质相互作用网络。Cytoscape软件对互作网络图进行修饰。
2 结果
2.1 M6结构特征及抗菌谱
M6的2D结构和3D结构见图1。1,3,4-二唑母核使M6发挥抗菌活性。M6的抗菌谱覆盖细菌和真菌,主要抑制革兰阳性(G+)致病菌,对革兰阴性(G-)菌和真菌抑制效果差,特别是对MTB、Ms MC2155和Cg的MIC分别为0.062 5μg·mL-1、32μg·mL-1和0.5μg·mL-1,见表1。因此,M6对MTB和Cg具有显著抑制效果。

图1 M6的2D(A)和3D(B)结构式
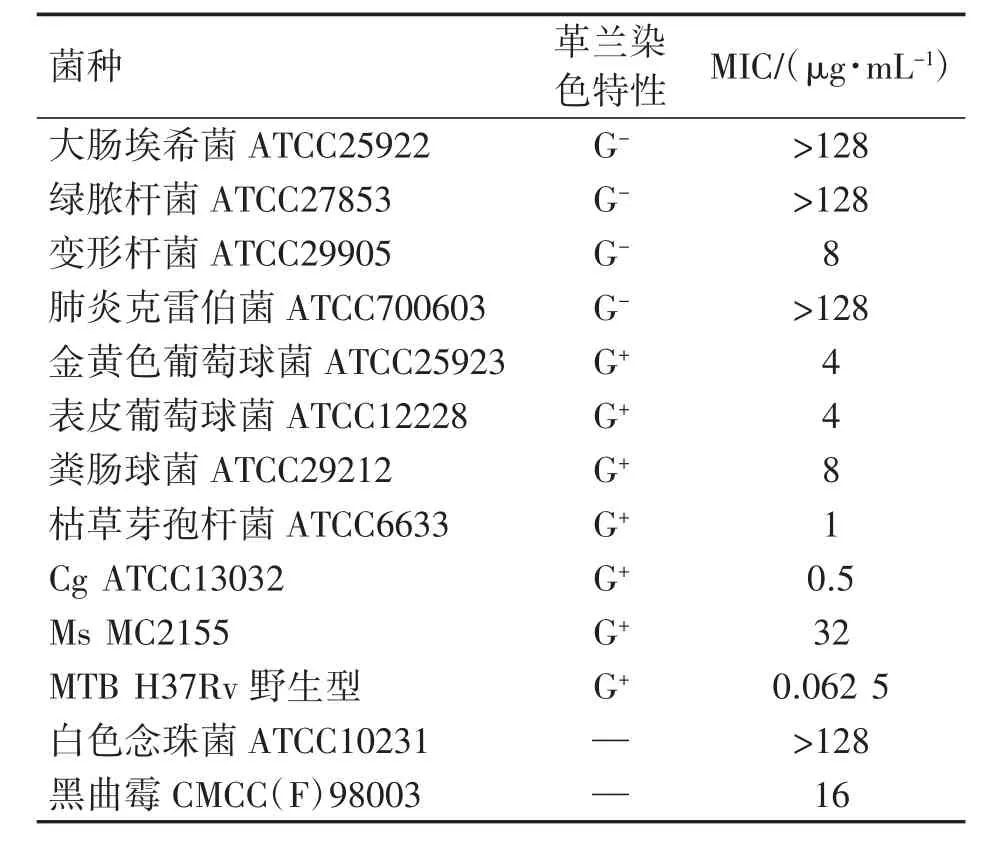
表1 M6的抗菌谱
2.2 M6对Cg和Ms的MIC
利用刃天青能够更好地观察M6干预后Cg和Ms的生长情况,借助酶标仪检测96孔板中菌液的OD600值,绘制细菌生长曲线。M6对Cg和Ms的MIC分别为0.5μg·mL-1和32μg·mL-1,Cg对M6更敏感,见图2。因此,选择Cg为模式菌株进行M6在转录组中影响的研究。
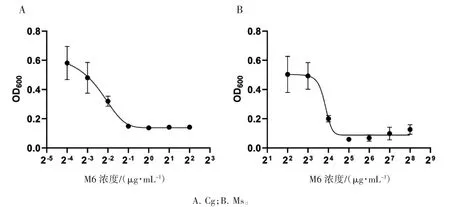
图2 M6对Cg和Ms的MIC值
2.3 测序数据质量评估
将M6处理前后的Cg原始序列和预处理序列的总数同Cg的参考基因组序列进行比对分析。C1~C3为3个批次Cg样品,S1~S3为3个批次M6预处理的Cg样品。利用FastQC软件对预处理数据进行质量控制分析并统计Q20和Q30碱基比例,STAR软件将预处理序列与测序物种的参考基因组序列进行比对。Q20在97.80%~98.05%,匹配率在36.50%~46.20%,见表2。另外,通过1%琼脂糖凝胶电泳检测Cg总RNA的完整性,3条清晰的条带(23S/16S/5S)说明RNA完整性良好,无弥散和杂条带,见图3。以上数据均证明样品质量良好,符合后续差异基因分析的样本要求。

表2 样品质量检测(%)

图3 总RNA琼脂糖凝胶电泳分析
2.4 M6干预Cg后的DEGs
DESeq2软件统计分析了DMSO和M6预处理组间的DEGs,筛选到452个差异表达的mRNA(P≤0.05,|log2FC|≥1.0),其中346个DEGs表达上调,106个DEGs表达下调,见图4。差异倍数4倍以上的DEGs共有40个(P≤0.05,|log2FC|≥2.0),其中6个DEGs表达下调(bioB、bioA、gip、hI_0095、DNA81和DNA345),34个DEGs表达上调(ctpA、ftn、dps、cmr、trxC和clpB等),部分差异倍数4倍以上,见表3。
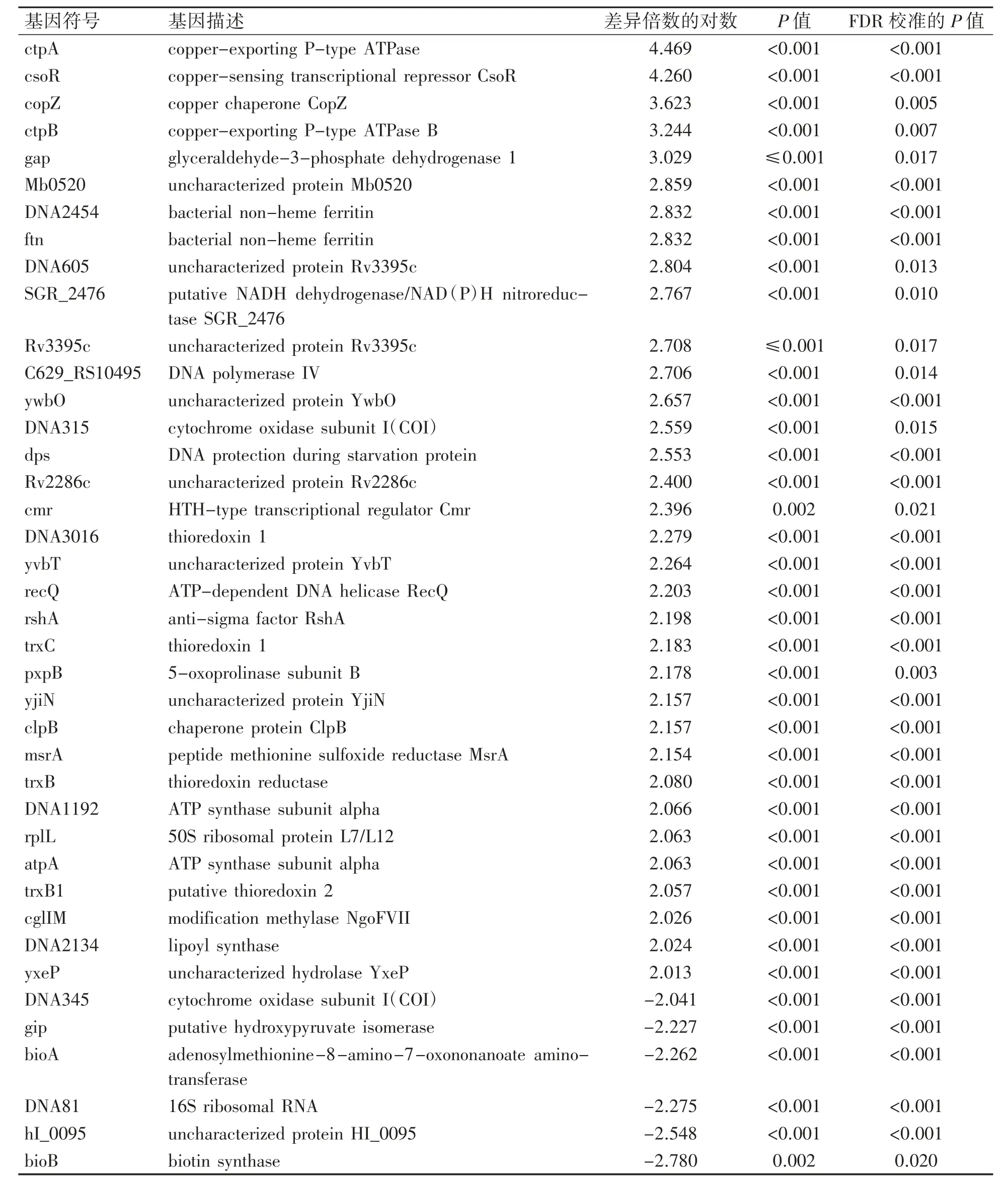
表3 4倍以上的DEGs
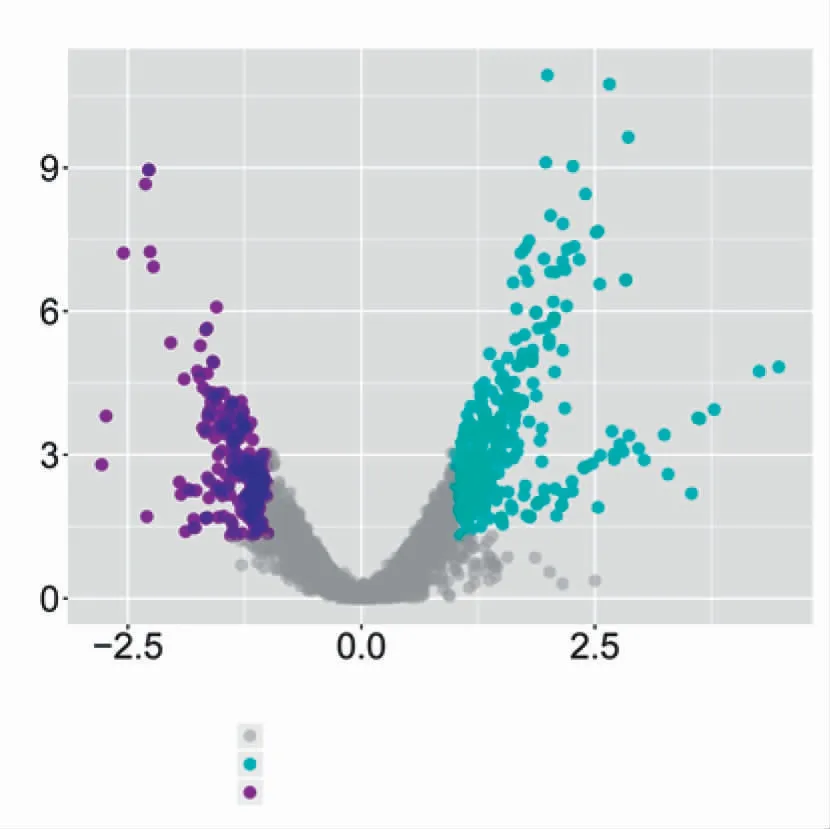
图4 两组样本间的火山图
2.5 DEGs的GO功能和KEGG通路分析
2.5.1 DEGs的GO功能分析 GO功能分析将筛选到的DEGs(P≤0.05,|log2FC|≥1.0)进行了细胞功能富集,DEGs分别富集到分子生物学过程(biological process,BP)、细胞学组分(cellular components,CC)和分子功能(molecular function,MF)三种功能途径中。DEGs主要富集在CC和MF功能途径。在CC中,主要富集在核糖体及其亚基上61个DEGs(rplL、sdhA、katA、rplJ、rplQ和rpmD等)、含蛋白复合体上89个DEGs(ctpA、ftn、trxC、clpB、rplL和atpA等)和核蛋白复合体上42个DEGs(rplL、sdhA、katA、rplJ和rplQ等)。在MF中,DEGs主要富集在核糖体结构中37个(rplL、rplJ、rplQ、rpmD、rplE、rpsl和rpsD等)、rRNA绑定中34个(rplQ、tig、rplE、rpsl、rpsD和rpsG等)及结构分子活性中38个(rplL、rplJ、rplQ、rpmD、rplE和rpsl等),见图5。所有DEGs富集的功能途径中,DEGs主要富集于核糖体结构相关生理功能。

图5 DEGs显著富集的GO功能柱状图
2.5.2 DEGs的KEGG通路分析 KEGG通路分析将基因定位到基因通路相关数据库结果显示,差异显著的通路有核糖体、氧化磷酸化、阳离子抗菌肽(CAMP)耐药性及硫代谢通路,以核糖体通路差异性最为显著。DEGs共有34个富集到核糖体通路中且均表达上调(P≤0.05,|log2FC|≥1.0),包括rplL、rplJ、rplQ、rpmD、rplE、rpsl和rpsD等主要与核糖体50S和30S亚基结构相关的基因。氧化磷酸化通路中富集到14个上调表达的DEGs(P≤0.05,|log2FC|≥1.0),包括atpA、atpG、sdhA、qcrC、atpH和atpD等。阳离子抗菌肽(CAMP)耐药性通路中富集到的DEGs有89个(P≤0.05,|log2FC|≥1.0),其中12个基因下调(bioA、ugpE、dctA等)和77个基因上调(ftn、dps、cmr、trxC、clpB、msrA和rplL等)。DEGs主要富集在核糖体通路及阳离子抗菌肽耐药性通路,见图6。

图6 KEGG通路功能注释
2.6 核心DEGs互作分析
根据GO功能及KEGG通路分析,对核糖体和阳离子抗菌肽通路中富集的98个DEGs进行蛋白质互作分析。选取网络边缘中心附近且互作关系强的DEGs,得到了由50个节点、982条连接线连接的DEGs互作网络图。在蛋白互作网络图中,rplQ、rplJ、rspD、rpmD、rpoA、rplE和rplL等差异表达基因处于网络中心节点,这些基因可能在菌体生命活动中占主要地位,也可能是M6干预的主要DEGs,见图7。

图7 DEGs的蛋白质相互作用网络
3 讨论
寻找新型、有效的抗MTB药物并研究其分子作用机制,将为TB的治疗提供潜在药物靶标,也将为耐药性TB治疗提供新的候选药物。 唑类抗生素在TB治疗中的应用相对较少,其中利奈唑胺用于治疗万古霉素耐药肠球菌等感染[8]。在TB治疗中,M6具有潜在的应用价值且抑菌机制有待进一步研究[9]。
在本研究获得差异倍数>4倍的基因中,ctpA编码重金属跨膜运输决定子P型ATP酶[10],在MTB中对铜离子的解毒作用显著[11]。ftn编码铁蛋白,其结构复杂,能够调整细胞内铁离子浓度,影响Cg的氧化应激[12]。dps编码一种铁蛋白,具有DNA结合、铁储存和铁氧化活性功能,可使细菌免受缺铁和氧化应激的胁迫[13],也可以影响脓肿分枝杆菌铁离子稳态和氧化应激反应[14]。Cmr编码螺旋-转角-螺旋转录调控因子,是一种氯霉素耐药性相关基因[15]。其他的DEGs包括bioB和bioA生物素合成相关基因[16]及trxC和trxB等硫代谢相关基因[17-18]等,均在菌体生命活动中发挥重要功能。对DEGs进行GO功能及KEGG通路分析发现,DEGs主要富集在核糖体相关功能和通路,以及阳离子抗菌肽耐药性通路中。核糖体作为一种合成细胞所有蛋白质的重要细胞器,结构及功能的特性使其成为抗生素及抗生素耐药性的主要靶点之一[19]。研究发现,半数以上的抗生素通过结合核糖体而抑制蛋白质合成,从而达到抑制致病菌的目的[20-22]。本研究发现,DEGs既涉及了50S核糖体亚基L12(rplL)、L10(rplJ)、L17(rplQ)和L30(rpmD)等,也涉及核糖体30S亚基S5(rpsE)、S4(rpsD)、S7(rpsG)和S11(rpsK)等。其中肺炎克雷伯氏菌耐药性与rplL有关[23],而且rplL蛋白作为抗原已经用于疫苗研发[24]。在TB治疗中发现rplJ和rpsl均与链霉素的耐药相关[25-28]。而rpmD核糖体相关基因则鲜有报道[29-30]。在KEGG通路分析中,阳离子抗菌肽耐药性通路也是DEGs富集的主要通路之一。阳离子抗菌肽作为一种有前景的耐药性治疗替代策略,在甲氧西林、青霉素、四环素等耐药性治疗的研究中有见报道[31-32]。由于核糖体保护基因optrA、poxtA以及其他与核糖体结构相关基因等发生突变,导致阳离子抗菌肽耐药性的产生[33-34]。在阳离子抗菌肽耐药性通路中富集的DEGs中,4倍以上差异表达的基因出现最多(ftn、dps、cmr、trxC、clpB、bioA和ugpE等)。M6是否可以通过干预阳离子抗菌肽耐药性相关基因而解决其耐药性问题,有待进一步分子机制的验证。而M6对核糖体及阳离子抗菌肽耐药性通路的影响,也将为核糖体相关的药物治疗及耐药性问题提供思路。结合DEGs分析、GO功能及KEGG通路分析,对核糖体及阳离子抗菌肽耐药性通路的DEGs进行蛋白互作网络分析。位于网络中心的DEGs主要涉及菌体核糖体相关功能(rplQ、rplJ、rspD、rplE、rpmD和rplL等),通过基因/蛋白互作网络进一步阐明了DEGs在细菌生命活动中的重要地位。而且,核糖体和阳离子抗菌肽通路中差异倍数高的DEGs不一定处于中心节点(ftn、dps、cmr、trxC和bioA等)。
综上所述,M6的作用很可能通过影响核糖体稳定相关基因,导致核糖体结构不稳定而发挥抑制作用。而M6调控阳离子抗菌肽耐药性相关基因的表达,提示M6与阳离子抗菌肽药物的作用有交叉。M6的应用将有望发现新的潜在靶标(rplL、rplJ、rplQ、rpmD、ftn、dps、cmr、trxC、bioA和ugpE等),为进一步开发和改造M6作用于TB治疗提供理论依据。

