辅助性T细胞在骨质疏松症发病机制中的研究进展
任国武 徐志为 温帅波 韩杰* 吴钰坤
1.广西中医药大学,广西 南宁 530299 2.广西中医药大学附属瑞康医院,广西 南宁 530011
骨质疏松症 (osteoporosis,OP)是以单位体积骨量减少、骨脆性增加、骨折风险增高为特点代谢性骨病[1]。随着人口老龄化和相关危险因素风险逐渐增高,在2018年国家卫健委公布的中国OP流行病学调查显示,50岁以上人群OP患病率为19.2 %,且低骨量率人群高达32.9 %[2]。传统观点认为OP的发生是破骨细胞和成骨细胞之间骨代谢的失衡,但骨骼除了作为骨骼系统组成成分支持人体的运动活动,同时骨也是一个多功能器官,能够沉积并维持钙和磷酸盐等矿物质的代谢平衡[3-4]。此外,骨骼的骨髓组织还富含造血干细胞和成熟的免疫细胞,其中免疫T细胞占骨髓细胞总数的5 %左右;T细胞对介导免疫系统的细胞免疫反应具有重要意义,目前根据T细胞不同的免疫应答中功能,将其分为初始T细胞、辅助性T细胞(Th细胞)、调节性T细胞、滤泡辅助性T细胞、自然杀伤T细胞、γδT细胞和CD8+T细胞等诸多亚群。在T细胞的诸多亚群中Th细胞为其他免疫细胞提供辅助功能;Th细胞根据各自的环境刺激可分化为相应的Th细胞亚群,这些Th亚群细胞进而分泌各种细胞因子和配体,最终影响骨的形成与吸收代谢过程[5-6]。在OP的研究中同样表明了,异常活化的Th细胞产生的炎症因子、配体可通过改变骨保护素(osteoprotegerin,OPG)与核因子-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)比例,抑制骨骼成骨能力减弱,增强骨吸收,破坏骨代谢平衡[7-9]。因此,本文从Th细胞在OP的发病作用机制做一综述,以期进一步明确免疫系统和骨骼系统之间的共享微环境作用机制。
1 CD4+T细胞
分化族蛋白(cluster of differentiation,CD)是免疫抗原辨识的细胞标志物,而由于Th细胞表面表达CD4,因此Th细胞又称CD4+T细胞[10]。Th细胞受到不同的刺激可分化为Th1、Th2、Th9、Th17、Th22、调节性T (Treg)和卵泡辅助性T (TFH)等亚群细胞,这些又执行相应的细胞因子以完成整个免疫应答。在生理条件下,Th细胞不分泌RANKL;相反,在炎症状态下活化的Th细胞表达RANKL和TNF-α,从而促进破骨细胞的形成和随后的骨质丢失[11]。研究[11-13]表明,相对于绝经后正常骨矿物质密度(BDM)妇女,绝经后OP或低BDM妇女血清中促骨吸收的因子TNF-α、IL-6、IL-12和IL-17升高,抗骨吸收因子IFN-γ、TGF-β、IL-4、IL-10、IL-13降低。OP疾病产生的特殊环境导致CD4+T细胞分化成不同亚型Th细胞,进而影响骨质代谢,参见图1。
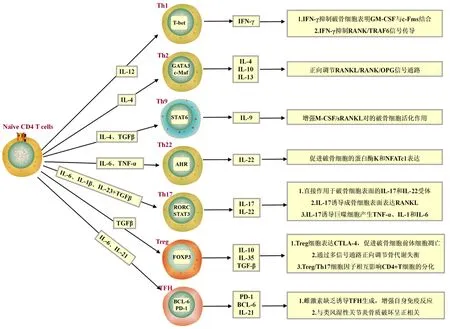
图1 辅助性T细胞分化以及骨代谢影响图Fig.1 Impact diagram of helper T cell differentiation and bone metabolism
1.1 Th1细胞
CD4+T细胞受到IL-12刺激能活化自身的STAT4转录因子;STAT4进而活化Th1细胞的特异转录因子STAT1和T-bet,导致CD4+T细胞分化为成熟的Th1细胞,此后Th1细胞分泌IFN-γ、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IL-2和TNF-α等因子参与免疫反应、骨代谢[14]。目前关于Th1细胞特异性分泌因子对骨细胞影响的研究主要集中于IFN-γ对破骨细胞分化的抑制作用,IFN-γ通过激活经典的JAK-STAT1通路,进而启动泛素-蛋白酶体对泛素连接酶TRAF6的降解,进而抑制下游转录因子NF-κB和JNK的表达,减少破骨细胞分化[15-16]。此外,IFN-γ下调破骨细胞前体单核巨噬细胞GM-CSF受体(c-Fms)的表达,抑制GM-CSF与c-Fms结合,进而干预破骨细胞增殖分化[16-18]。IFN-γ同样是增强Th1细胞增殖分化的正向反馈因子,尽管在OP血清中显示IL-12升高,但IFN-γ分泌水平降低,可能是OP的特殊炎症导致Th1细胞形成减少有关。在Th1与骨髓来源的巨噬细胞(BMM)共培养研究表明,活化的Th1通过分泌IFN-γ抑制了BMM向破骨细胞分化以及随后的成熟[15]。尽管Th1细胞的分泌因子呈现出促进(GM-CSF、TNF-α)或抑制(IFN-γ、IL-2)骨质吸收两种相反的作用,可能是活化状态下的Th1特异性分泌的IFN-γ干扰了其他因子的作用,见图2。
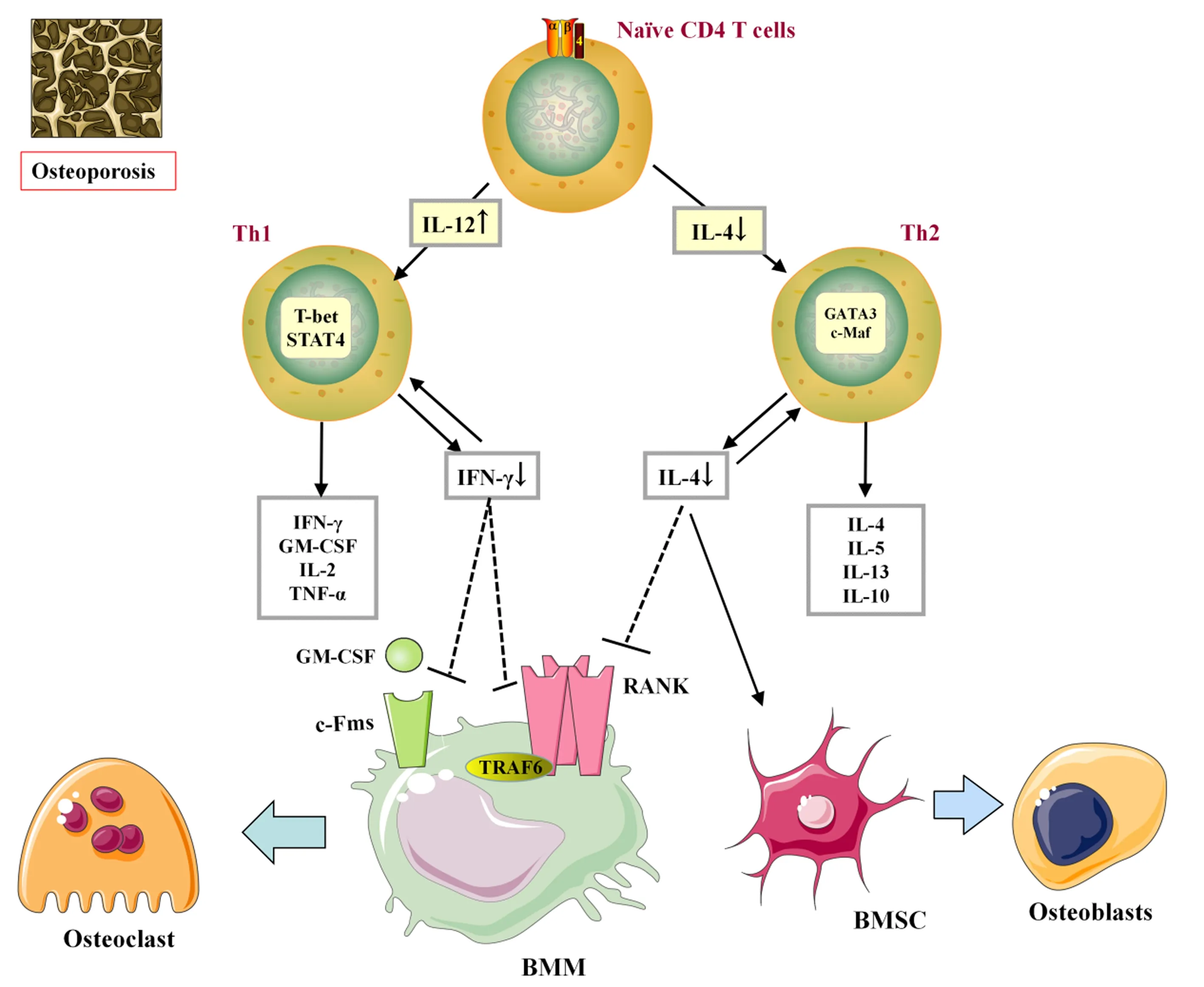
注:Th1细胞、Th2细胞特异性分泌因子分别为IFN-γ、IL-4,但在OP的病理环境下使得IFN-γ、IL-4均下降,导致Th1细胞、Th2细胞正反馈扩张与分化减少;进而减弱了IFN-γ对破骨细胞分化增殖相关蛋白GM-CSF、TRAF6的抑制作用;减弱了IL-4对破骨与成骨失衡的改善作用。
1.2 Th2细胞
Th2细胞主要分泌IL-4、IL-10、IL-13等,其中IL-4、IL-10和IL-13具有抑制破骨细胞形成的作用,其可升高OPG并减低RANKL、RANK的表达[19-21]。IL-4还能促进M2型巨噬细胞极化改变,减弱巨噬细胞向破骨细胞分化,并促进成骨细胞增殖与骨髓间充质干细胞成骨分化[22-23]。在Th2细胞执行因子中,IL-4类似于Th1细胞中的IFN-γ,IL-4是Th2细胞的正向反馈因子,IL-4会刺激Th细胞的信号转导子和转录活化子STAT6磷酸化以及GATA结合蛋白3(GATA3)的上调,IL-4-STAT6-GATA3信号不断促进Th2细胞分化和扩增的正反馈机制[24]。研究表明,在雌激素缺乏OP小鼠中Th2细胞的GATA-3和IL-4表达降低;且Th2细胞数量的减少与骨密度、雌激素水平下降呈现正相关[25]。体外实验[26]也表明,在T细胞存在情况下IL-4对 RANKL诱导的破骨细胞生成具有抑制作用,而分离培养T细胞与破骨细胞则消除了IL-4的抑制破骨生成的作用,见图2。
1.3 Th9、Th22细胞
Th9细胞作为最近定义的产生IL-9的Th细胞亚群,尚缺少与OP直接作用关系研究,但在系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、牙周炎等疾病发现了IL-9与骨质吸收关系,Kar等[27]研究表明,IL-9的刺激显着增强M-CSF/RANKL对破骨细胞活化作用,并上调基质金属蛋白酶 (MMP) 的表达加剧骨质降解。Díaz-Zúiga等[28]研究表明,Th9细胞可调节Th17、Th22细胞介导的骨质吸收活性。Th22细胞也是一种最近定义的产生IL-22的Th细胞,Th22细胞与Th17细胞结构相似,两者均表达趋化因子受体(CCR)4和CCR6且能产生IL-22,但除此之外Th22细胞也表达CCR10,因此,Th22细胞需要TNF-α、IL-6刺激芳基烃受体(AHR)才能从CD4+T细胞分化[29]。目前关于也暂缺Th22细胞与OP直接作用关系研究,但Miyazaki等[30]研究表明,相较于RANKL、M-CSF共培养生成的破骨细胞数量,Th22细胞与Th17细胞共培养生成破骨细胞数量明显增多,且IL-22以浓度依赖性促进破骨细胞的蛋白酶K和活化T细胞核因子1(NFATc1)mRNA的表达。在炎症环境的作用下Th22也参与了破骨细胞形成的过程,但是在OP环境下Th22细胞对于破骨细胞的作用机制尚待进一步研究,图3。
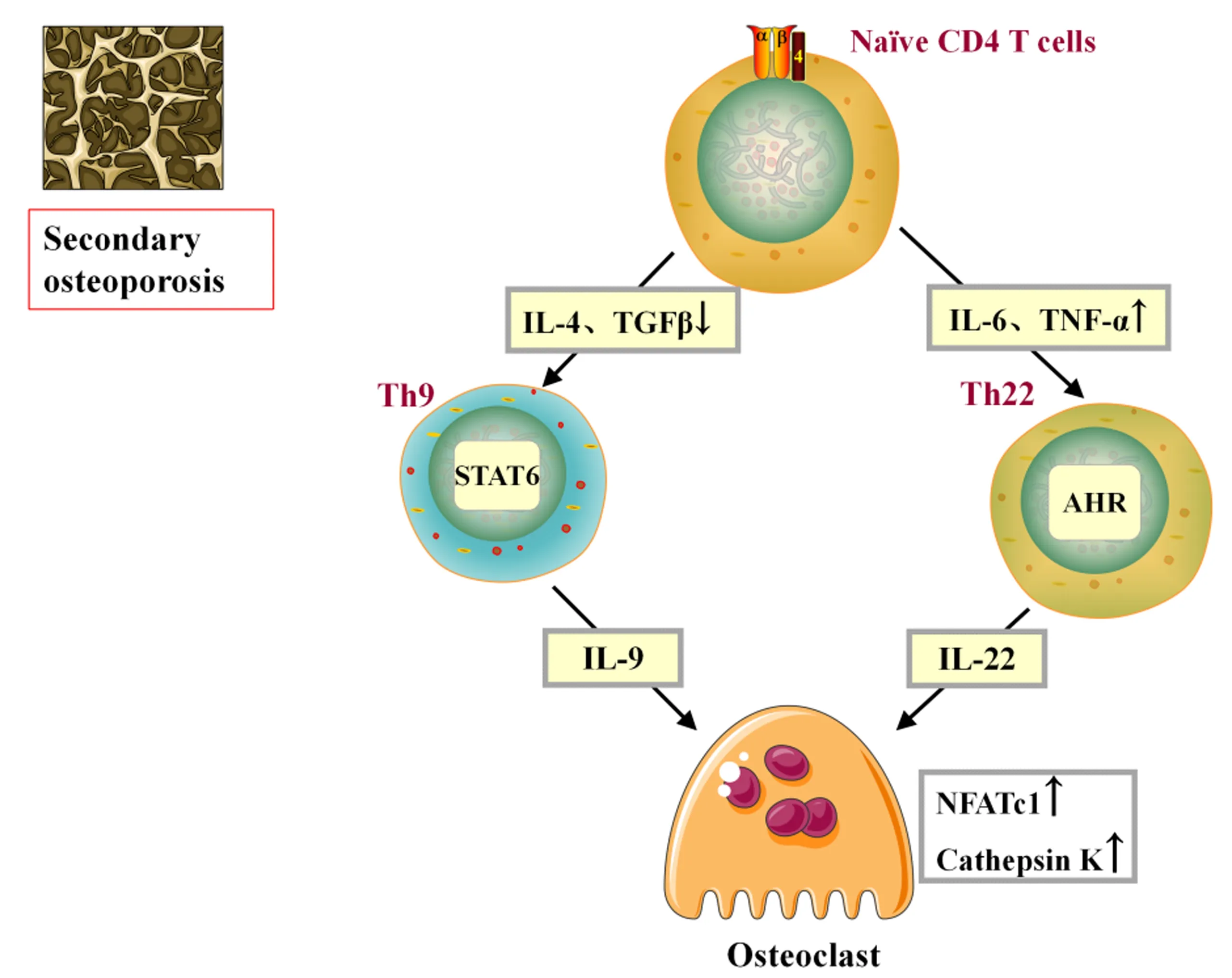
注:尽管Th9、Th22细胞在OP研究尚少,但Th9的激活因子在OP中呈现低表达;且其他继发性的骨质破坏或体外研究证实了IL-9的刺激能增强破骨细胞活化,Th22细胞对破骨细胞分化以及骨吸收能力具有促进作用。
1.4 Th17细胞
CD4+T细胞受到TGF-β、IL-6、IL-1β和IL-23的刺激,活化Th17细胞特异性转录因子的ROR-γt 、STAT3并向Th17细胞分化,活化的Th17细胞主要分泌IL-17和IL-22[31]。Th17细胞至少通过4个方面作用促进破骨细胞形成:①Th17细胞自身RANKL表达:在Th17细胞分化过程中Th17细胞表面表达RANKL以促进其自身分化,且BMM与Th17细胞具有共享髓系谱系,共同循环于血液中,Th17细胞表面的RANKL诱导破骨细胞表面RANK信号的生成,促进了破骨前体细胞分化为破骨细胞[32-34]。②Th17细胞直接诱导作用:Th17细胞分泌的IL-17和IL-22可直接作用于破骨细胞表面的受体,促进破骨细胞分化以及骨侵蚀能力[35-37]。③Th17细胞间接诱导作用:Th17细胞分泌的IL-17诱导成骨细胞表面表达RANKL间接促进破骨形成;IL-17诱导巨噬细胞产生TNF-α、IL-1和IL-6等多种炎症因子,这些炎症因子又通过诱导成骨细胞表达RANKL,促进破骨细胞活化[37-39]。④正向反馈作用:IL-17诱导巨噬细胞产生的IL-1和IL-6等炎症因子对于Th17细胞的活化又存在促进作用,活化的Th17细胞又从多个方面促进破骨细胞形成,最终形成Th17-IL-17-巨噬细胞-IL-1、IL-6-Th17的正向反馈链[39-41]。OP的相关研究[42]则表明,雌激素的缺乏导致STAT3、ROR-γt 和 ROR-α等Th17细胞特异性因子表达增加,Th17细胞分泌的IL-17增加破骨细胞RANK、TRAP mRNA的表达和成骨细胞 IL-17R(IL-17受体)、TNF-α、IL-6、RANKL等促进破骨因子的表达,而通过雌激素干预能够逆转Th17细胞分化以及随后IL-17的诱导作用,见图4。
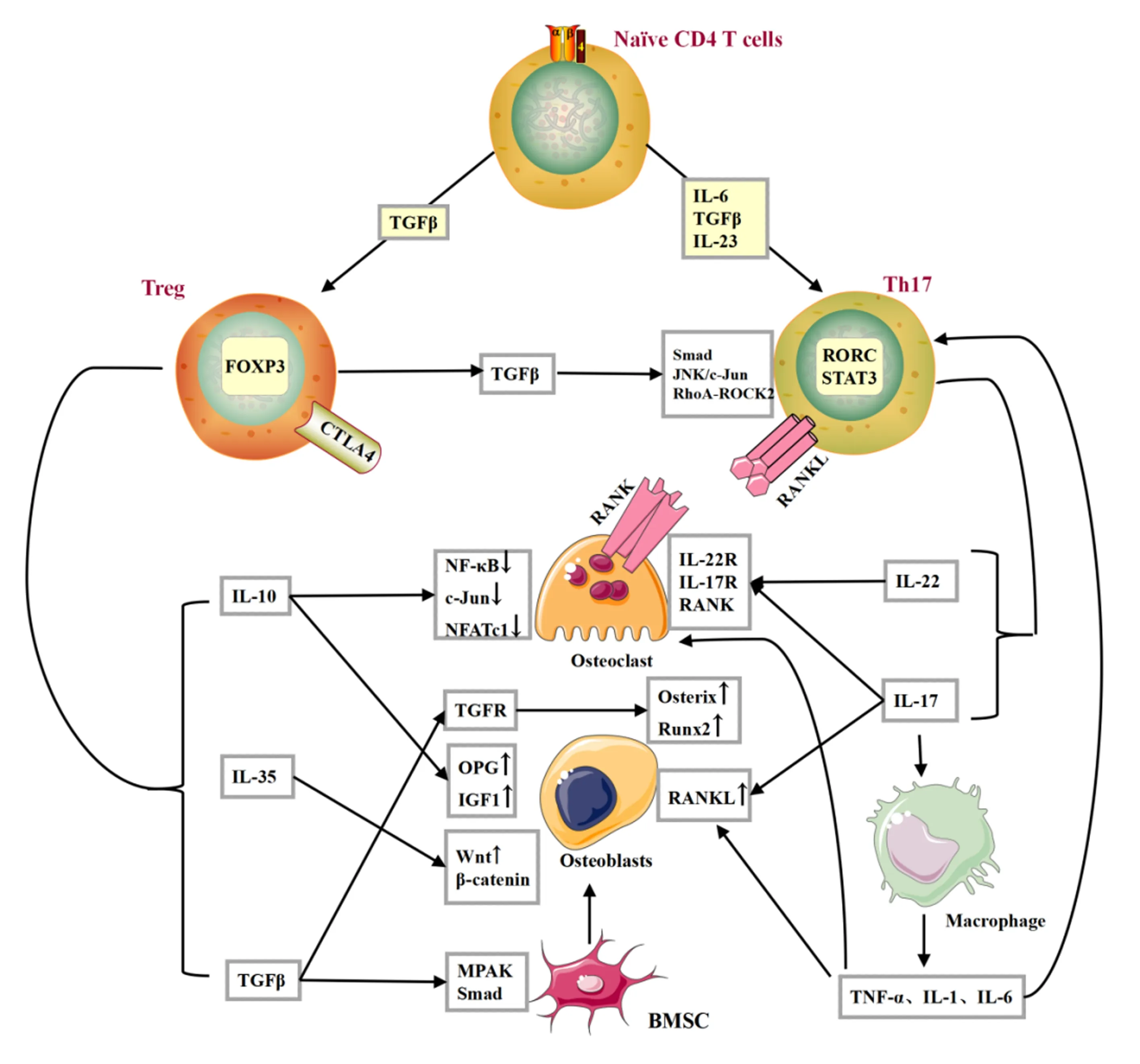
注:在T细胞与骨代谢的研究中以Treg、Th17细胞较为多见。①两者均可通过细胞间接触作用参与调节骨代谢过程,Treg细胞通过CTLA-4诱导破骨凋亡,Th17细胞通过RANKL促进破骨分化。②两者的分泌因子对骨代谢呈现相反作用。③两者之间的分化受到OP炎症环境的作用,显示出了Treg细胞减少、Th17细胞增多。
1.5 Treg细胞
Treg细胞主要分为两类:自然性Treg细胞(nTregs或tTregs)和调节性Treg细胞(iTregs);nTregs自然存在于胸腺中,iTreg是在自身抗原或外源性的刺激下由外周CD4+T细胞产生。研究[43]表明,CD4+T细胞受到IL-2、TGF-β刺激活化iTreg细胞特异性转录因子(Foxp3),iTreg细胞分泌IL-10、IL-35、TGF-β等因子。Treg细胞影响骨代谢主要有3方面机制:细胞接触凋亡机制,细胞因子抑制机制,Treg/Th17细胞平衡机制,见图4。
1.5.1细胞接触凋亡机制:Fischer等[43]表明,Foxp3 +Treg细胞会表达细胞毒性T淋巴细胞相关抗原-4(CTLA-4),表达CTLA-4的Treg细胞与破骨前体细胞表面的共刺激分子CD80/CD86结合,诱导破骨细胞前体细胞中吲哚胺-2,3-双加氧酶(IDO)的活化。活化的IDO降解色氨酸,促进破骨前体细胞凋亡,从而抑制骨吸收[44]。Oi等[45]的研究同样表明,CTLA-4-lg能够抑制RANKL对BMM细胞的破骨的诱导作用,降低破骨分化因子(NFATc1)、吸收因子(组织蛋白酶K)以及破骨标志物(TRAP)的表达;且流式细胞术分析结果表明在TNF-α诱导破骨细胞表面CD80表达的情况下,相较于CD86,CD80对CTLA-4-Ig显示出更高亲和力,呈现出更强的破骨抑制效果。
1.5.2细胞因子抑制机制:Foxp3 +Treg细胞分泌IL-10、IL-35、TGF-β等因子参与骨吸收与重塑代谢过程,研究[46]表明,IL-10能够降低RANKL诱导的NF-κB、c-Jun、NFATc1破骨因子表达,并能促进成骨细胞分泌OPG、胰岛素样生长因子1(IGF1),产生抑制破骨、促进成骨的作用。IL-35能升高成骨细胞OPG/RANKL比值,且能通过激活Wnt/β-catenin 信号促进成骨细胞分化[47]。TGF-β激活细胞内效应因子如MPAK、Smad蛋白诱导间充质干细胞向成骨分化;类似的成骨细胞表面也存在多种亚型TGF-β受体,TGF-β与相应受体结合后也会诱导成骨细胞分泌Osterix、Runx2等促成骨因子[48]。
1.5.3Treg/Th17细胞平衡机制:CD4+T细胞是Treg、Th17细胞的共同前体细胞,Treg、Th17细胞的分化均受到了TGF-β信号的调节。在缺乏IL-6和其他促炎因子的情况下,TGF-β会诱导CD4+T细胞表达Treg细胞的特异转录因子Foxp3,Foxp3可以直接与Th17细胞分化的特异转录因子ROR-γt相互作用并拮抗ROR-γt表达,最终促进CD4+T细胞向Treg细胞并减少向Th17细胞分化[50-51]。但在TGF-β、IL-6和IL-23存在的情况下,IL-6、IL-23共刺激作用会诱导CD4+T细胞STAT3表达,STAT3进而产生抑制Foxp3表达的作用,促进CD4+T细胞向Th17细胞分化。但也不能单纯的认为TGF-β对TH17细胞分化只有抑制效果,研究[49-50]表明,TGF-β经典信号通路TGF-β/SMAD诱导的SMAD是Th17细胞的共激活剂和共抑制剂,可以反向修饰STAT3诱导的转录;此外,TGF-β通过激活其他的信号通路如JNK/c-Jun、RhoA-ROCK2信号,上调ROR-γt、IL-17和IL-21的表达。
1.6 TFH细胞
TFH细胞也由CD4+T细胞分化而来,TFH细胞受到B细胞反应时会刺激生发中心 (GC) 生成自身抗体来参与多种免疫疾病(如类风湿性关节炎和系统性红斑狼疮)。TFH细胞表达各种独特的基因与因子,如CXCR5、CD40 L、程序性细胞死亡-1 (PD-1)、BCL-6和IL-21等等[51]。Kim等[51]敲除T细胞的雌激素受体(ERα)会促进CD4+T细胞向CXCR5 + Bcl-6 + TFH细胞分化和抗原抗体反应,而使用雌激素治疗能降低 IL-21和Bcl-6的表达。Greisen等[52]临床研究也表明,在类风湿性关节炎患者血清中TFH分泌因子PD-L1、IL-21升高,且这些因子与影像学上的关节破坏、骨质侵蚀呈现正相关。Li等[53]的研究同样表明,在血吸虫感染引发骨质流失过程中,TFH细胞数量增加且高表达RANKL,进而介导了破骨细胞形成,图1。尽管目前关于TFH细胞-破骨细胞培养体系研究尚少,但诸多证据支撑TFH细胞与炎症、免疫以及缺乏激素疾病诱发的OP存在关联性。
2 结论
无论是原发性OP还是继发性OP的发病均涉及骨骼与免疫系统之间的动态平衡关系失调。但目前临床上的诸多药物,如双膦酸盐、雷奈酸锶、雌激素、特立帕肽等药物的药理学研究主要集中于干预骨质代谢的作用机理,对于骨骼与免疫系统共享环境的作用机制研究尚少。因此,本文通过阐述Th细胞在OP的作用机制,了解OP特殊炎症病理情况下的骨代谢与Th细胞的关联机制,有助于开发新型治疗策略。近年来益生菌、肠道菌群调节免疫系统来改善骨质流失的补充疗法就代表了骨免疫学的治疗观点。但本文也存在局限性,文章主要描述Th细胞自身以及其分泌因子在OP的发病机制,对于其他亚型的T细胞和免疫细胞论述不足,尚不能阐明骨骼与免疫系统的关系。未来应当增加各种类型免疫细胞与各类骨细胞相互作用机制的研究,以期进一步明确免疫系统在各种原因骨代谢失衡的作用机制,从骨免疫学角度防治OP的发生与发展。

