miR-23b-3p调控肾间质成纤维细胞成骨样分化参与Randall斑形成的机制研究
雷 波,邱明星,刘健男
肾结石是晶体物质在肾脏的异常聚积所致,是一种常见的泌尿系统疾病。据报道,2016年我国肾结石的患病率约为 5.8%~7.5%[1],而2020年美国肾结石患病率约为10%[2]。目前,临床常采用超声、手术治疗肾结石,但存在易复发、尿路感染及肾脏损伤等隐患。研究[3]表明,超过70%结石类型为草酸钙(calcium oxalate,CaOx))结石,其起源于肾乳头钙化斑块Randall斑,而Randall斑的形成与肾组织细胞成骨分化有关[4]。研究[5]显示,miR-23b-3p在Randall斑与正常肾乳头状组织中差异表达。肌细胞增强因子2(myocyte enhancer factor 2,MEF2)C是MEF2亚家族的成员之一,在MgCl2诱导的成骨分化后的小鼠间充质干细胞中表达上调[6]。上述研究结果提示,miR-23b-3p和MEF2C均参与细胞成骨分化过程,但具体调控机制不明。因此,该研究旨在探讨miR-23b-3p是否通过靶向调控MEF2C对肾间质成纤维细胞(human renal interstitial fibroblasts,hRIFs)成骨样分化的影响,旨在为防治CaOx结石提供新方向。
1 材料与方法
1.1 病例资料选取2019年11月至2021年6月期间在西南医科大学临床学院治疗的37例CaOx结石患者的Randall斑(Randall plaque, RP)组织作为研究组,另收集同时期26例在西南医科大学临床学院接受肾切除术的肾肿瘤患者的正常乳头状(normal Randall plaque, nRP)组织作为对照组。其中研究组患者男性20例,女性17例,年龄范围:21~63(43±8.57)岁;对照组患者均无泌尿系结石病史,其中男性14例,女性12例,年龄范围:28~62(41±6.28)岁。两组患者年龄、性别差异无统计学意义。本研究通过本院伦理委员会批准(编号:LZ201901023),患者和家属均签署知情同意书。RP和nRP组织标本通过手术取出后迅速置于液氮中,之后将标本移至-80 ℃冰箱冻存,用于后续实验。
1.2 主要试剂和仪器DMEM/F12培养基、opti-MEM培养基、胎牛血清购自美国Gibco公司;β-甘油磷酸钠、地塞米松、维生素C购自美国Sigma公司;青-链霉素(P-S)、成骨细胞矿化结节染色试剂盒(茜素红S法)、Triton X-100、牛血清白蛋白(BSA)、Lipo8000TM转染试剂、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;人碱性磷酸酶(alkaline phosphatase,ALP)ELISA试剂盒购自武汉菲恩生物科技有限公司;miR-23b-3p过表达质粒pSi-miR-23b-3p及其阴性空载质粒pSi-NC、MEF2C慢病毒过表达质粒Lv-MEF2C(滴度:4.51×108TU/ml)及其空载质粒Lv-NC(滴度:1.73×108TU/ml)、miR-23b-3p mimic及其阴性对照mimic NC由上海汉恒生物科技有限公司合成;双荧光素酶报告基因检测试剂盒、pmirGLO载体购自武汉金开瑞生物工程有限公司;通用逆转录试剂盒、SYBR premix Ex Taq PCR试剂盒购自北京索莱宝科技有限公司;miRNA第一链cDNA合成试剂盒、miRNA qPCR试剂盒购自武汉艾美捷科技有限公司;引物由武汉赛维尔生物科技有限公司合成;波形蛋白(Vimentin)抗体、钙黏蛋白E(E-cadherin)抗体、MEF2C抗体、GAPDH抗体购自美国Affinity公司;Cy3标记的羊抗兔二抗、HRP标记的羊抗兔二抗购自武汉爱博泰克生物科技有限公司。超净工作台(SW-CJ-2D)购自苏州净化设备有限公司;CO2培养箱(MCO-18AC)购自日本松下公司;倒置荧光显微镜(XD-202)南京江南永新光学有限公司;酶标分析仪(AMR-100)购自杭州奥盛仪器有限公司;化学发光成像系统(ChemiDoc Touch)购自美国Bio-Rad公司。
1.3 方法
1.3.1hRIFs细胞分离、培养及鉴定 主刀医师对肾肿瘤患者行肿瘤切除手术,取距肿瘤边缘> 5 cm处1 mm3大小的正常组织块,参考张和平 等[7]胶原酶法分离出hRIFs细胞,用含10%胎牛血清、1% P-S 的DMEM/F12完全培养基,置于37 ℃、5% CO2培养箱中培养,每3~4 d换液1次。显微镜下观察细胞生长状态,待细胞生长至80%~90%融合度时,以1 ∶2传代比例进行传代培养。选取第2代(P2)对数生长期细胞,采用免疫荧光实验鉴定hRIFs,观察细胞中Vimentin和E-cadherin蛋白表达及分布情况,Vimentin阳性表达、E-cadherin阴性表达即为hRIFs细胞。
1.3.2hRIFs细胞成骨诱导及成骨分化能力鉴定 取第3代对数生长期hRIFs细胞,以1×105个细胞/孔接种至6孔板,置于培养箱过夜,更换成骨诱导液(10% 胎牛血清+0.1 μmol地塞米松+10 mmol β-甘油磷酸钠+50 μg/ml 维生素C+1% P/S+DMEM/F12)继续培养,每2~3 d换液1次。分别于第0、3、5、7、14 天时,取细胞上清按下述ELISA法检测ALP活性,绘制标准曲线,计算各组细胞上清中ALP水平(ng/ml);取细胞按下述qRT-PCR法检测成骨标志物(OCN、OPN、Runx2)mRNA表达水平;于成骨诱导第14 天采用下述茜素红染色法检测细胞矿化结节形成情况。
1.3.3 实验分组及细胞转染取第3代对数生长期hRIFs细胞,以1×105个细胞/孔接种至6孔板,置于培养箱过夜。第一部分探讨miR-23b-3p过表达对hRIFs细胞成骨样分化的影响,先将hRIFs细胞分为3组:① blank组;② pSi-NC组,转染携带pSi-NC质粒至细胞中;③ pSi-miR-23b-3p组,转染携带pSi-miR-23b-3p过表达质粒至细胞中;转染成功后各组均成骨诱导14 d。第二部分探究miR-23b-3p通过调控MEF2C基因表达参与hRIFs细胞成骨样分化的调节作用,先将hRIFs细胞分为4组:① pSi-NC组;② pSi-miR-23b-3p组;③ pSi-miR-23b-3p+Lv-NC组,共转染携带pSi-miR-23b-3p过表达质粒和Lv-NC慢病毒至细胞中;④ pSi-miR-23b-3p+Lv-MEF2C组,共转染携带pSi-miR-23b-3p过表达质粒和Lv-MEF2C慢病毒至细胞中,转染成功后均成骨诱导14 d。参照转染试剂说明书,使用opti-MEM培养基和Lipo8000转染试剂将pSi-miR-23b-3p过表达质粒及其阴性空载质粒pSi-NC转入hRIFs细胞中,转染6 h后更换新鲜培养基,48 h后收集部分细胞采用1.3.5项方法检测转染效率, 病毒转染:参照病毒转染说明书,使用含5 μg/ml聚凝胺完全培养基稀释慢病毒,将慢病毒Lv-MEF2C及其空载病毒Lv-NC以感染复数为200感染hRIFs细胞,16 h后更换新鲜培养基,48 h后置于荧光显微镜下观察感染效率。
1.3.4茜素红检测细胞矿化结节情况 去除培养液,PBS洗涤1次,4 %多聚甲醛固定20 min,PBS洗3次,加入适量茜素红S染色液,室温孵育30 min,PBS洗3次,显微镜下观察和拍照细胞矿化结节情况。
1.3.5qRT-PCR检测 收集RP和nRP组织、成骨诱导不同时间(0、3、5、7、14 d)及1.3.3项下第一部分和第二部分各组处理后的细胞,加入TRIzol裂解液提取总RNA,mRNA检测:使用逆转录试剂盒将样本逆转录为cDNA,使用SYBR premix Ex Taq PCR试剂盒进行mRNA荧光定量分析;miRNA检测:使用miRNA第一链cDNA合成试剂盒将样本逆转录为cDNA,使用miRNA qPCR试剂盒进行miRNA荧光定量分析。引物序列见表1。反应条件:95 ℃预变性60 s,95 ℃、20 s,65 ℃、30 s,共循环40次。以U6和GAPDH为内参,采用2-△△Ct法计算RP和nRP组织及各组细胞中miR-23b-3p和MEF2C、OCN、OPN、Runx2 mRNA表达水平。

表1 引物序列表
1.3.6Western blot检测 消化离心收集成骨诱导不同时间(0、3、5、7、14 d)及1.3.3项下第一部分和第二部分各组处理后的细胞,加入预冷PBS洗涤1次,加入适量含蛋白酶抑制剂的RIPA细胞裂解液,冰上裂解30 min后于4 ℃、12 000 r/min离心提取总蛋白。使用BCA蛋白定量试剂盒进行蛋白定量,将蛋白样品使用金属浴煮沸10 min变性,各组取40 μg蛋白上样进行电泳,进行转膜处理后加入封闭液室温孵育1 h,TBST洗涤3次,加入一抗MEF2C抗体(1 ∶1 000),GAPDH抗体(1 ∶5 000),4 ℃孵育过夜。TBST洗涤3次,加入HRP标记的羊抗兔二抗(1 ∶2 000),室温孵育1 h,滴加ECL显影液,曝光,采用ImageJ软件分析条带灰度值,以GAPDH为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.3.7双荧光素酶报告基因实验验证miR-23b-3p与MEF2C靶向关系 采用miRNA靶基因在线预测网站TargetScanHuman 7.2预测miR-23b-3p与MEF2C的靶向结合位点,并在hRIFs细胞中验证miR-23b-3p与MEF2C的靶向关系。将野生型(WT)和突变型(MUT)MEF2C序列构建入pmirGLO载体中(WT-MEF2C和MUT-MEF2C)。取P3代对数生长期hRIFs细胞,以5 104个/孔接种至24孔板中,采用Lipo8000转染试剂将WT-MEF2C和MT-MEF2C质粒与miR-23b-3p mimic或mimic NC共转染48 h。参照双荧光素酶报告基因检测试剂盒说明书进行检测,采用荧光酶标仪测定相对光度(relative light unit,RLU)值并计算荧光素酶活性。荧光素酶活性=萤火虫荧光素酶RLU值/海肾荧光素酶RLU值。
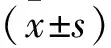
2 结果
2.1 CaOx结石患者Randall斑组织中miR-23b-3p与MEF2C表达水平及其相关性与nRP组织比较,RP组织中miR-23b-3p表达水平明显降低(P<0.05),而MEF2C mRNA表达水平明显升高(P<0.05)。见图1A、B。Pearson相关性分析结果显示,在RP组织中,miR-23b-3p与MEF2C mRNA表达水平呈负相关关系(r=-0.462,P=0.004)见图1C。
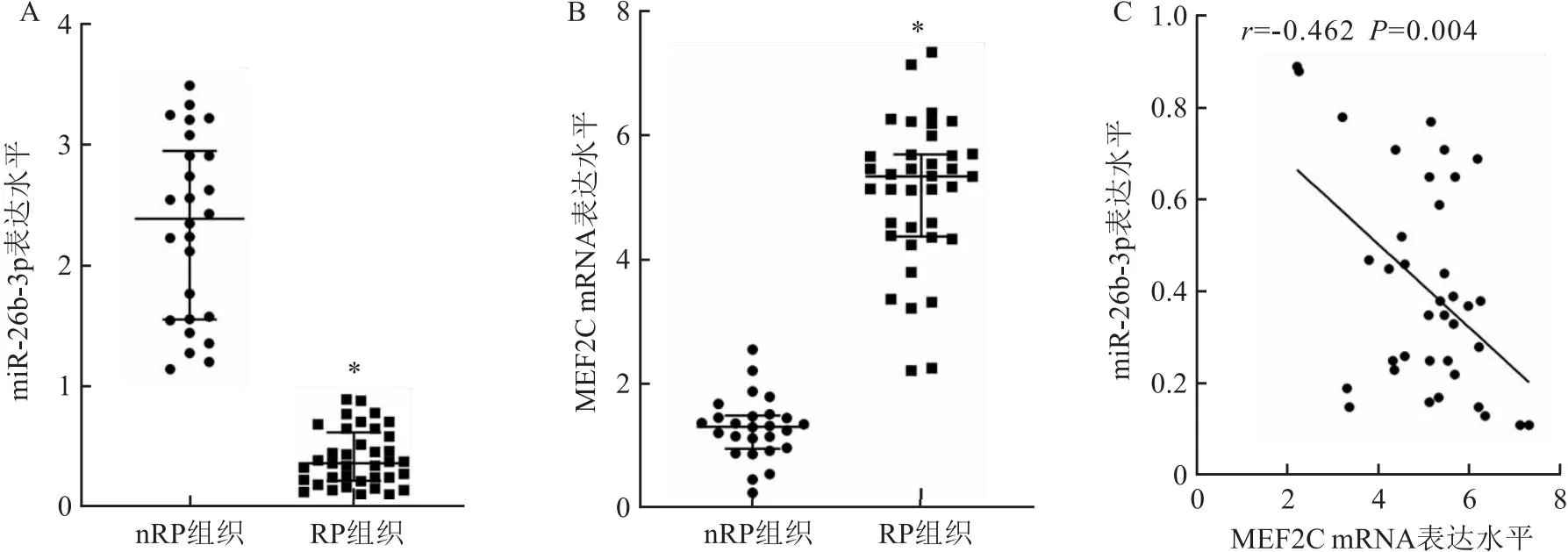
图1 CaOx结石患者Randall斑组织中miR-23b-3p与MEF2C表达水平及其相关性分析
2.2 Vimentin和E-cadherin在hRIFs细胞中的分布特点免疫荧光结果显示,细胞中Vimentin蛋白呈阳性表达,E-cadherin蛋白呈阴性表达,提示hRIFs细胞分离成功。见图2。
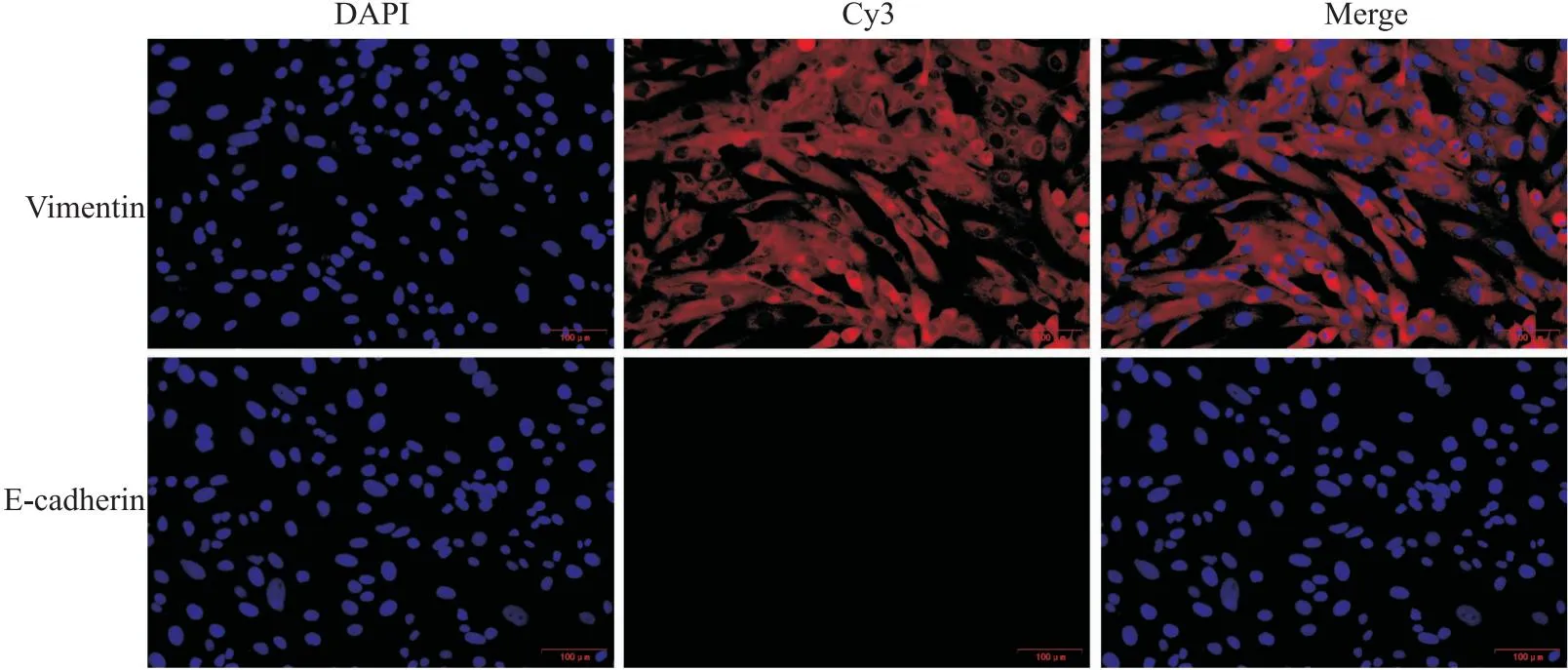
图2 hRIFs细胞中Vimentin蛋白和E-cadherin蛋白表达 免疫荧光 ×400
2.3 成骨诱导液对hRIFs细胞矿化结节、ALP水平及成骨标志物的变化茜素红染色结果显示,与0 d比较,成骨诱导至14 d时细胞时出现矿化结节。见图3A。ELISA结果显示,不同成骨诱导时间(3、5、7、14 d)ALP水平分别为(12.12±0.68)ng/ml、(20.33±3.57)ng/ml、(30.65±2.88)ng/ml、(45.81±3.33)ng/ml,(80.26±5.49)ng/ml;细胞中ALP水平随成骨诱导时间延长呈上升趋势(t=3.91、10.86、17.19、21.34,均P<0.05)。见图3B。qRT-PCR结果显示,不同时间点的细胞中OCN、OPN、Runx2 mRNA表达水平差异具有统计学意义(tOCN=9.82、16.93、9.93、16.90,均P<0.05;tOPN=5.05、10.35、13.94、23.25,均P<0.05;tRunx2=15.24、21.55、9.58、14.72,均P<0.05),且随着时间的延长,细胞中OCN、OPN、Runx2 mRNA表达水平逐渐上升。见图3C。
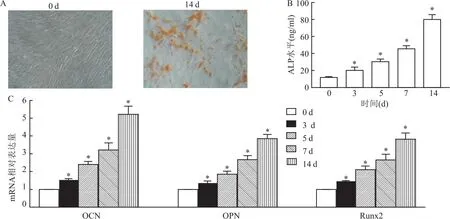
图3 hRIFs细胞成骨诱导分化鉴定
2.4 miR-23b-3p过表达对hRIFs细胞成骨样分化的影响qRT-PCR结果显示,与0 d比较,随着成骨诱导时间(3、5、7、14 d)的延长,细胞中miR-23b-3p表达水平均逐渐降低(t=6.43、6.33、22.58、154.20,均P<0.05)。见图4A。与blank组或pSi-NC组比较,pSi-miR-23b-3p组hRIFs细胞中miR-23b-3p表达水平明显升高(t=18.20、18.04,均P<0.05),提示miR-23b-3p过表达成功。见图4B。各组hRIFs细胞成骨诱导14 d后,与blank组或pSi-NC组比较,pSi-miR-23b-3p组细胞中成骨标志物OCN、OPN、Runx2 mRNA表达水平均明显降低(t=22.25、12.18,10.39、8.59、53.96、20.91,均P<0.05)。见图4C。茜素红染色结果显示,各组hRIFs细胞成骨诱导14 d后,与blank组或pSi-NC组比较,pSi-miR-23b-3p组细胞形成矿化结节能力减弱。见图4D。
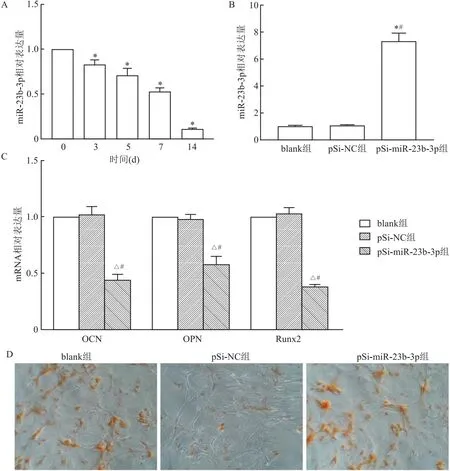
图4 miR-23b-3p过表达对hRIFs细胞成骨样分化的影响
2.5 MEF2C基因参与hRIFs细胞成骨样分化的调节qRT-PCR和Western blot结果显示,与0 d比较,随着成骨诱导时间(3、5、7、14 d)的延长,细胞中MEF2C mRNA和蛋白表达水平逐渐升高(tmRNA=4.07、11.17、9.01、14.45,均P<0.05;t蛋白=5.42、14.72、14.79、8.91,均P<0.05)。见图5。
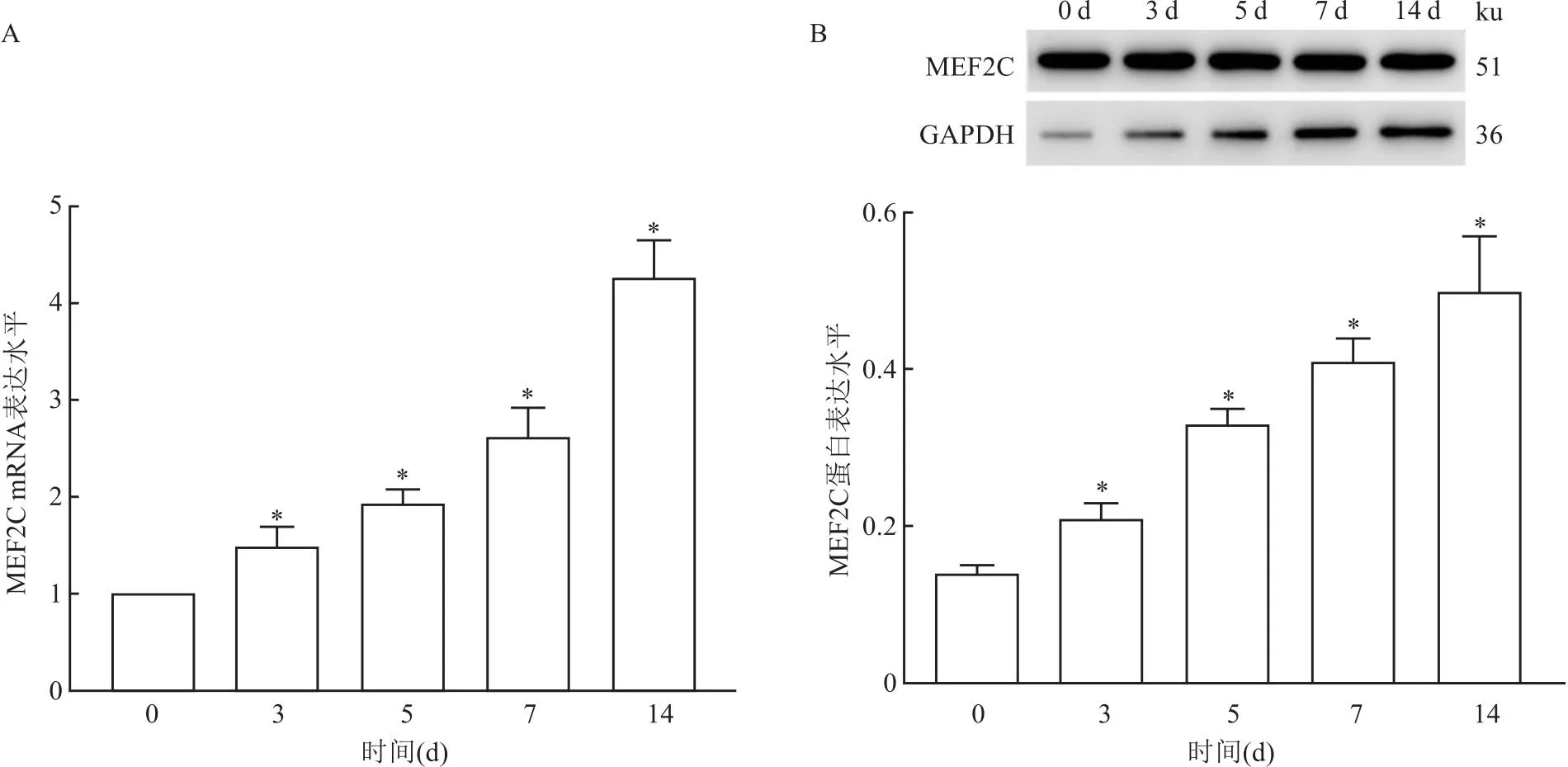
图5 qRT-PCR(A)和Western blot(B)检测不同成骨诱导时间点细胞中MEF2C mRNA和蛋白表达水平
2.6 miR-23b-3p通过调控MEF2C基因表达参与hRIFs细胞成骨样分化的调节细胞转染后,qRT-PCR和Western blot结果显示,与pSi-NC组比较,pSi-miR-23b-3p组和pSi-miR-23b-3p+Lv-NC组hRIFs细胞中MEF2C mRNA和蛋白表达水平明显降低(均P<0.05);与pSi-miR-23b-3p+Lv-NC组比较,pSi-miR- 23b-3p+Lv-MEF2C组hRIFs细胞中MEF2C mRNA和蛋白表达水平明显升高(均P<0.05)。见图6A、6B。成骨诱导14 d后,与pSi-NC组比较,pSi-miR-23b-3p组和pSi-miR-23b-3p+Lv-NC组细胞中OCN、OPN、Runx2 等mRNA表达水平明显降低(均P<0.05);pSi-miR-23b-3p+Lv-NC组比较,pSi-miR-23b-3p+ Lv-MEF2C组细胞中OCN、OPN、Runx2 等mRNA表达明显升高(均P<0.05)。见图6C。茜素红染色结果显示,与pSi-NC组比较,pSi-miR-23b-3p组和pSi-miR-23b-3p +Lv-NC组细胞矿化结节形成能力减弱;与pSi-miR-23b-3p+Lv-NC组比较,pSi-miR-23b-3p+Lv-MEF2C组细胞矿化结节能力形成增强。见图6D。
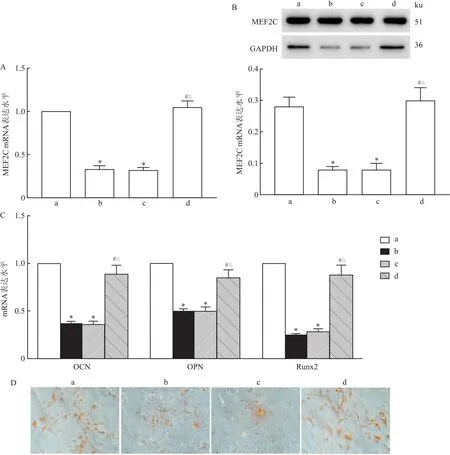
图6 miR-23b-3p通过调控MEF2C基因表达参与hRIFs细胞成骨样分化的调节
2.7 miR-23b-3p靶向负调控MEF2CmiRNA靶基因在线预测网站TargetScanHuman 7.2预测结果显示,miR-23b-3p与MEF2C 3′-UTR区域存在互补的结合位点。见图7A。双荧光素酶基因检测报告结果显示,在MUT-MEF2C细胞中,与mimic NC组(1.01±0.04)比较,miR-23b-3p mimic组细胞荧光素酶活性(0.23±0.01)明显降低(P<0.05);然而,在WT-MEF2C细胞中,与mimic NC组(1.02±0.05)比较,miR-23b-3p mimic组细胞荧光素酶活性(0.98±0.04)无明显变化(P>0.05)。见图7B。表明miR-23b-3p能靶向负调控MEF2C表达。另外,qRT-PCR和Western blot结果显示,与blank组或pSi-NC组比较,pSi-miR-23b-3p组细胞中MEF2C mRNA和蛋白表达水平明显降低(均P<0.05)。见图7C、7D。
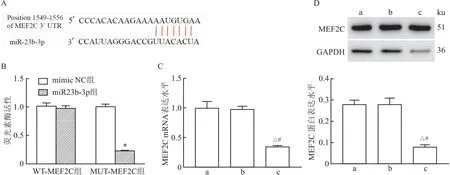
图7 miR-23b-3p与MEF2C靶向关系验证
3 讨论
Randall斑是一种肾乳头上皮组织下存在的钙化斑块,始发于髓袢细段肾小管上皮细胞的基底膜,逐渐延伸至肾髓质的间质,最后沉积在肾乳头的间质组织中。O′Kell et al[8]认为,Randall斑是特发性CaOx结石形成的先决条件,CaOx成核并附着于Randall斑上,进一步发展形成结石。临床研究[9]发现,Randall斑覆盖的面积与CaOx结石数量呈正相关。张一帆 等[10]研究通过分析Randall斑结石患者24 h尿液成分分析发现Randall斑患者24 h尿液中草酸、磷酸、钠、钙含量显著升高。因此,Randall斑与CaOx结石形成关系密切,值得深入研究。
近年来,miR-23b-3p在骨代谢的作用机制受到广泛关注。Li et al研究[11]表明,miR-23b-3p在绝经后骨质疏松症的小鼠骨组织中表达上调,降低其表达可上调Runx2、OCN、Osterix的表达和提高ALP活性从而促进小鼠骨髓间充质干细胞成骨分化。Yu et al研究[12]显示,lncRNA RP11-84C13.1通过吸收miRNA-23b-3p上调Runx2表达,从而诱导人骨髓间充质干细胞成骨分化。Zhu et al[13]研究显示,hRIFs成骨样分化增强可促进Randall斑的形成。而本研究结果显示,与正常乳头状组织比较,CaOx结石患者Randall斑组织中miR-23b-3p表达水平下调;且体外细胞实验结果显示,miR-23b-3p高表达可下调成骨标志物(OCN、OPN、Runx2)mRNA表达水平,降低细胞矿化结节形成的能力,从而抑制hRIFs细胞成骨分化。提示miR-23b-3p可能具有通过抑制hRIFs成骨样表型进而阻止Randall斑形成的潜能。
MEF2C是MEF2家族转录因子之一,其编码的蛋白质参与多种生物进程,如心血管系统发育、肌肉生成和骨代谢。近年来研究[14]显示,MEF2C在骨代谢过程中发挥促进作用。Jiang et al研究[15]发现,MEF2C在成骨分化后的人骨髓间充质干细胞中表达上调,沉默其表达可抑制骨髓间充质干细胞成骨分化。因此,MEF2C可能成为抑制细胞成骨分化的重要靶点,从而抑制Ranall斑形成。本研究结果显示,与正常乳头状组织比较,CaOx结石患者Randall斑组织中MEF2C表达水平上调,推测MEF2C高表达可能促进Randall斑形成,确定其作用机制可以为CaOx结石的早期诊断和治疗提供新的理论基础。然而miR-23b-3p与MEF2C是否调控hRIFs细胞成骨分化从而参与Randall斑形成尚未可知。因此,本研究将miR-23b-3p过表达质粒转入hRIFs细胞中,发现miR-23b-3p过表达可下调MEF2C表达水平,双荧光素酶实验结果也表明miR-23b-3p可靶向调控MEF2C,提示miR-23b-3p可能通过靶向下调MEF2C从而抑制细胞成骨分化,从而抑制Randall斑形成。为进一步验证结论,本研究将miR-23b-3p过表达质粒和MEF2C过表达质粒共转染hRIFs细胞,显示MEF2C过表达可逆转miR-23b-3p过表达对hRIFs细胞成骨分化抑制作用,提示miR-23b-3p可通过靶向调控MEF2C抑制hRIFs细胞成骨分化从而参与Randall斑形成。
综上所述,miR-23b-3p在CaOx结石患者Randall斑组织中低表达,且miR-23b-3p可靶向调控MEF2C抑制hRIFs细胞成骨分化,从而参与Randall斑形成,最终导致CaOx结石产生,本研究为CaOx结石的防治提供了一个新的潜在靶点。但仍存在一些不足之处,本研究仅从细胞层面研究了miR-23b-3p与MEF2C调控肾间质成纤维细胞成骨分化,后续将从动物层面着手,构建CaOx结石动物模型,深入探究miR-23b-3p与MEF2C对体内CaOx结石的作用机制。

