小麦穗型相关生长素通路基因发掘及TaARF23-A 与小穗数关联分析
谭 丹 陈家婷 郜 钰 张晓军 李 欣 闫贵云 李 锐 陈 芳 常利芳 张树伟 郭慧娟 畅志坚 乔麟轶
山西农业大学农学院 / 作物遗传与分子改良山西省重点实验室 / 农业农村部有机旱作农业重点实验室(部省共建), 山西太原 030031
穗是小麦的重要器官。小麦穗部形态与穗长、小穗数等农艺性状密切相关, 直接影响植株产量。小麦穗型的建立可分为3 个阶段, 即开花转变期、小穗起止期和小花起止期[1]。其中, 小穗起止期是花序结构形成的关键阶段, 涉及小穗的起始、排布和终止, 最终决定了小穗数目[2]。生长素是调控该时期小穗发育的主要内源激素之一, 可通过浓度梯度和信号传导两个方面来调节小穗的分化和排列[1,3]。
植物生长素一般由色氨酸(tryptophan, TRP)通过色胺(tryptamine, TRA)途径或非色胺途径合成[4]。在大麦小穗起止期, 色胺途径受到基因调控而增强, 合成的生长素在小穗中从上到下浓度逐渐升高, 这种梯度分布影响大麦穗部棱型和侧小穗发育, 增加了每穗小穗数和小穗密度进而提高产量[5-7]。此外, 生长素还作为信号分子进入细胞核, 通过激活生长素响应因子(Auxin Response Factors,ARFs)来促进或抑制下游靶基因的表达, 进而调控小穗发育[3,8]。ARFs 在决定小穗分生组织命运和花序结构方面发挥着关键作用[2,9]。在小麦小穗出现双脊(double ridge)之前,ARFs 就已经开始受到生长素诱导而上调[8]。小麦品种科农9204 幼穗中的ARFs 在逆境环境下整体保持了较高的转录水平, 其单株穗数和小穗数显著高于对照品种[10]。
为了进一步发掘小麦穗型相关的生长素通路基因,本研究选择了2 个穗部形态差异明显的小麦品系SY95-71和CH7034, 对其小穗起止期幼穗的内源生长素含量和转录组进行了比较分析, 从中鉴定候选基因; 并利用SY95-71 和CH7034 的RILs 群体及其多年多点穗部表型数据对候选基因开展关联分析验证, 以期为穗型发育机制解析提供参考, 并为小麦理想穗型改良提供分子标记。
1 材料与方法
1.1 试验材料
小麦品系SY95-71 和CH7034 在GS24 时期(Growth Stage 24)[11]的幼穗用于内源生长素测定、转录组测序和qRT-PCR。其中, SY95-71 由四川农业大学舒焕麟副研究员和电子科技大学杨足君教授共同选育[12]; CH7034 由山西农业大学(原山西省农业科学院)畅志坚研究员选育[13]。SY95-71 和CH7034 的RIL 遗传群体(含184 家系)及其在6 个大田环境下(2014 年成都、2015 年成都、2016 年运城两点、2015 年临汾和2016 年临汾)的穗长、每穗小穗数和穗密度数据用于候选基因与穗型的相关性分析。上述材料均由作物遗传与分子改良山西省重点实验室提供。
1.2 生长素含量测定
将样本研磨后取50 mg 溶于1 mL 加有内标混合溶液的甲醇∶水∶甲酸 (15∶4∶1, v/v/v)提取剂, 离心取上清液浓缩, 再复溶于100 μL 80%甲醇中, 过滤后上样, 利用液相色谱-串联质谱(LC-MS/MS)系统检测生长素合成途径中的 5 个化合物含量, 包括色氨酸 TRP、吲哚乙酸(Indole-3-acetic acid, IAA)、以及色胺途径的色胺TRA、非色胺途径的吲哚乙酰胺(Indole-3-acetamide, IAM)和吲哚已腈(Indole-3-acetonitrile, IAN)。设置3 个生物学重复。
1.3 转录组测序
利用Illumina 平台对样品进行测序, 测序数据经筛选后比对小麦品种中国春基因组参考序列(IWGSC_RefSeq_v1.1), 将比对上的reads 进行组装和定量。采用FPKM 值作为衡量基因表达水平的指标。以|log2(FPKMSY/FPKMCH)|≥1 和 probability ≥0.8 为标准筛选差异表达基因(differentially expressed genes, DEGs), 相关结果用MeV 输出。基于百迈客云服务器工具(https://international.biocloud.net/)获得DEGs 的功能注释和GO 富集等信息。设置3 个生物学重复。
1.4 qRT-PCR
使用RNA 提取试剂盒(北京天漠)提取样品总RNA, 利用反转录试剂盒(大连宝生物)将其反转录为cDNA。使用TB GreenTaqII 酶(大连宝生物)在QuantStudio 3 定量PCR仪(美国ABI)上完成qRT-PCR 反应, 内参基因为小麦Actin,相关引物A1-q 和A2-q 列于表1。每个反应重复3 次, 所得结果采用2–ΔΔCT法进行分析。设置5 个生物学重复。
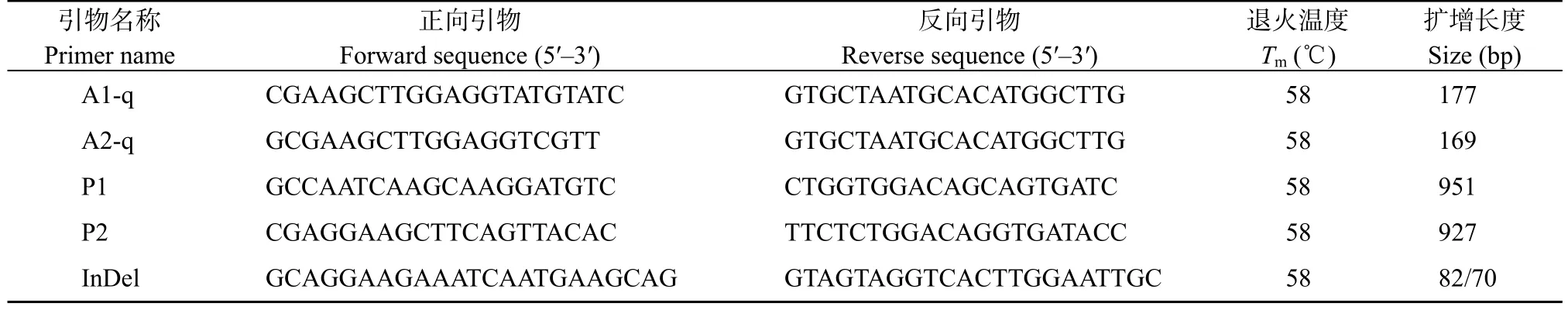
表1 TaARF23 相关引物Table 1 Primers related TaARF23
1.5 标记开发
采用CTAB 法提取SY95-71、CH7034 及其RILs 群体叶片的基因组DNA。利用Taq酶(大连宝生物)以及引物P1 和P2 扩增亲本中的候选基因, 将PCR 产物经1.2%琼脂糖凝胶电泳后挖胶测序。根据基因在 SY95-71 和CH7034 中的序列差异开发分子标记扩增RILs 群体DNA,产物用8%非变性聚丙烯酰胺凝胶(Acr∶Bis=29∶1)电泳检测、硝酸银染色, 记录标记型。
1.6 关联分析
RILs 群体的每个家系种植1 行, 行长2 m, 共种植15株。待植株成熟后每行随机选择5 株, 鉴定主穗最底部小穗至最顶部小穗的距离(不含芒长)计为穗长、主穗所有小穗数目计为小穗数, 将小穗数除以穗长获得穗密度。利用t检验对RILs 群体穗部表型和候选基因标记型之间的相关性进行分析, 设P<0.05 为差异显著。
2 结果与分析
2.1 SY95-71 和CH7034 幼穗中生长素含量差异显著
SY95-71 与CH7034 具有不同的穗型, 前者为长芒、纺锤型穗, 后者为无芒、圆形密穗(图1)。对2 份材料幼穗中的生长素含量进行测定, 结果显示, 吲哚乙酸IAA 和底物色氨酸TRP 的含量没有显著差异; 非色胺途径中的吲哚乙酰胺IAM 和吲哚已腈IAN 在幼穗中含量较低, 也没有显著差异; 色胺途径中的关键物质色胺 TRA 在SY95-71 幼穗中含量为98.58 ng g–1, 极显著高于CH7034中的18.63 ng g–1(P=0.001, 图2)。据此推测, 色胺途径可能是SY95-71 与CH7034 幼穗中生长素合成的主要来源;由于TRA 是IAA 的前体, 其在幼穗中的含量差异可能是造成两者不同穗型的原因之一。

图1 小麦品系SY95-71 和CH7034 的穗型Fig.1 Spike morphology of wheat lines SY95-71 and CH7034
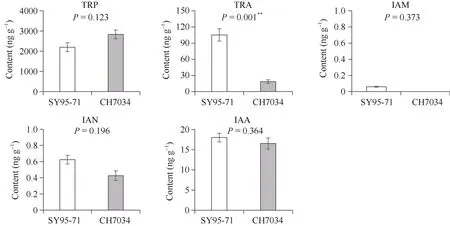
图2 生长素合成通路中5 个化合物在SY95-71 和CH7034 幼穗间的含量比较Fig.2 Comparison of the content of five compounds in the auxin synthesis pathway between young spikes of SY95-71 and CH7034
2.2 生长素相关GO 富集分析
对SY95-71 和CH7034 幼穗中的DEGs 进行GO 富集,从中筛选生长素相关条目。结果显示(图3), 在SY95-71中高表达的DEGs 被富集到14 个生长素相关条目, 其中生物进程类(biological process, BP) 11 个、分子功能类(molecular function, MF) 3 个; 在CH7034 中高表达的DEGs 被富集到12 个生长素相关条目, 其中BP 类8 个、MF 类4 个。
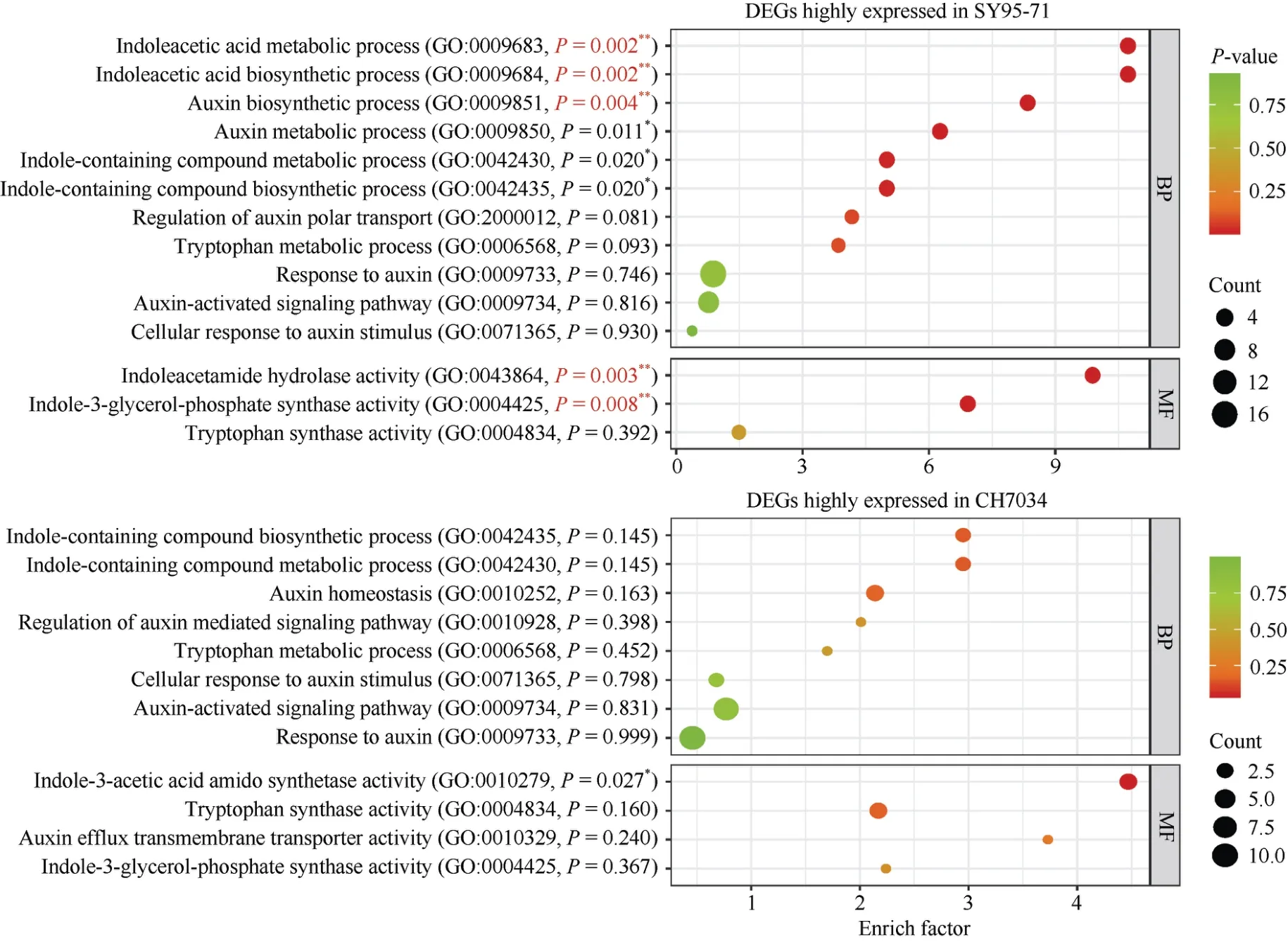
图3 SY95-71 和CH7034 幼穗中生长素通路相关的GO 富集Fig.3 GO enrichment related to auxin pathway in young spike of SY95-71 and CH7034
在高置信区间(P<0.01)范围内, 只有SY95-71 中富集到5 个生长素相关条目, 即 BP 类别中的吲哚乙酸代谢(indoleacetic acid metabolic process, GO:0009683)、吲哚乙酸生物合成(indoleacetic acid biosynthetic process, GO:0009684)和生长素生物合成(auxin biosynthetic process, GO:0009851),以及MF 类别中的吲哚乙酰胺水解酶活性(indoleacetamide hydrolase activity, GO:0043864)和吲哚-3-甘油-磷酸合酶活性(indole-3-glycerol-phosphate synthase activity, GO:0004425)。除了GO:0004425 以外, 其余4 个条目均是SY95-71 中富集到的特有条目, 猜测这些特有条目可能与SY95-71 幼穗中较高的TRA 含量有关。
2.3 SY95-71 幼穗中的生长素通路DEGs
我们从SY95-71 幼穗转录水平显著高于CH7034 的DEGs 中筛选了与生长素生物合成和信号转导相关的5 类基因(图4), 分别是TDC(TryptophanDecarboxylase)、ARF、Aux/IAA(Auxin/IndoleAceticAcid)、SAUR(Small AuxinUpRNA)和GH3(Gretchen-Hagen3)。其中,TDC编码色氨酸脱羧酶, 负责将色氨酸TRP 转化为色胺TRA;ARF编码生长素响应因子, 可调控下游原初响应基因Aux/IAA、SAUR和GH3的表达水平。与CH7034 相比, 上述DEGs 在SY95-71 中极显著高表达的有1 个TDC基因(TraesCS4A02G43150)、2 个ARF基因(TraesCS7A02 G475700、TraesCS7A02G475600)和 3 个SAUR基因(TraesCS7D02G456500、TraesCS7D02G456400、TraesCS7 A02G468700)。
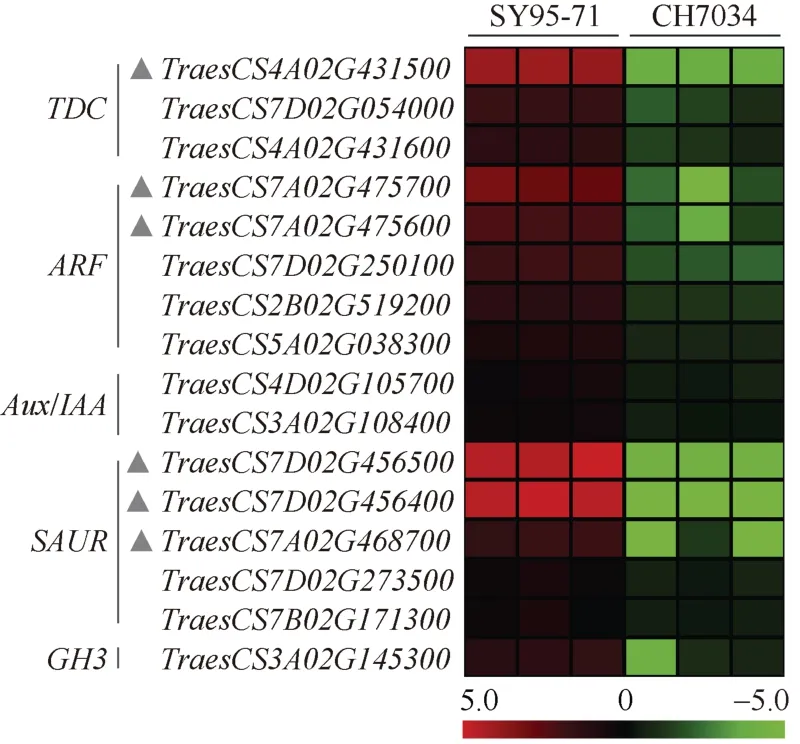
图4 SY95-71 幼穗中生长素通路相关DEGsFig.4 DEGs related to auxin pathway in young spike of SY95-71
2.4 TaARF23-A 的qRT-PCR 验证
ARF 既是生长素的响应因子, 又能在信号传导路径中作为转录因子调控下游基因网络。因此, 我们进一步分析了在SY95-71 幼穗中转录水平最高的2 个ARF基因。在中国春参考基因组中,TraesCS7A02G475600和TraesCS7A02G475700是位于7A 染色体长臂上同一位点的一对串联重复基因(图5-a), 根据小麦ARF 家族成员编号[14], 将其分别命名为TaARF23-A1和TaARF23-A2。
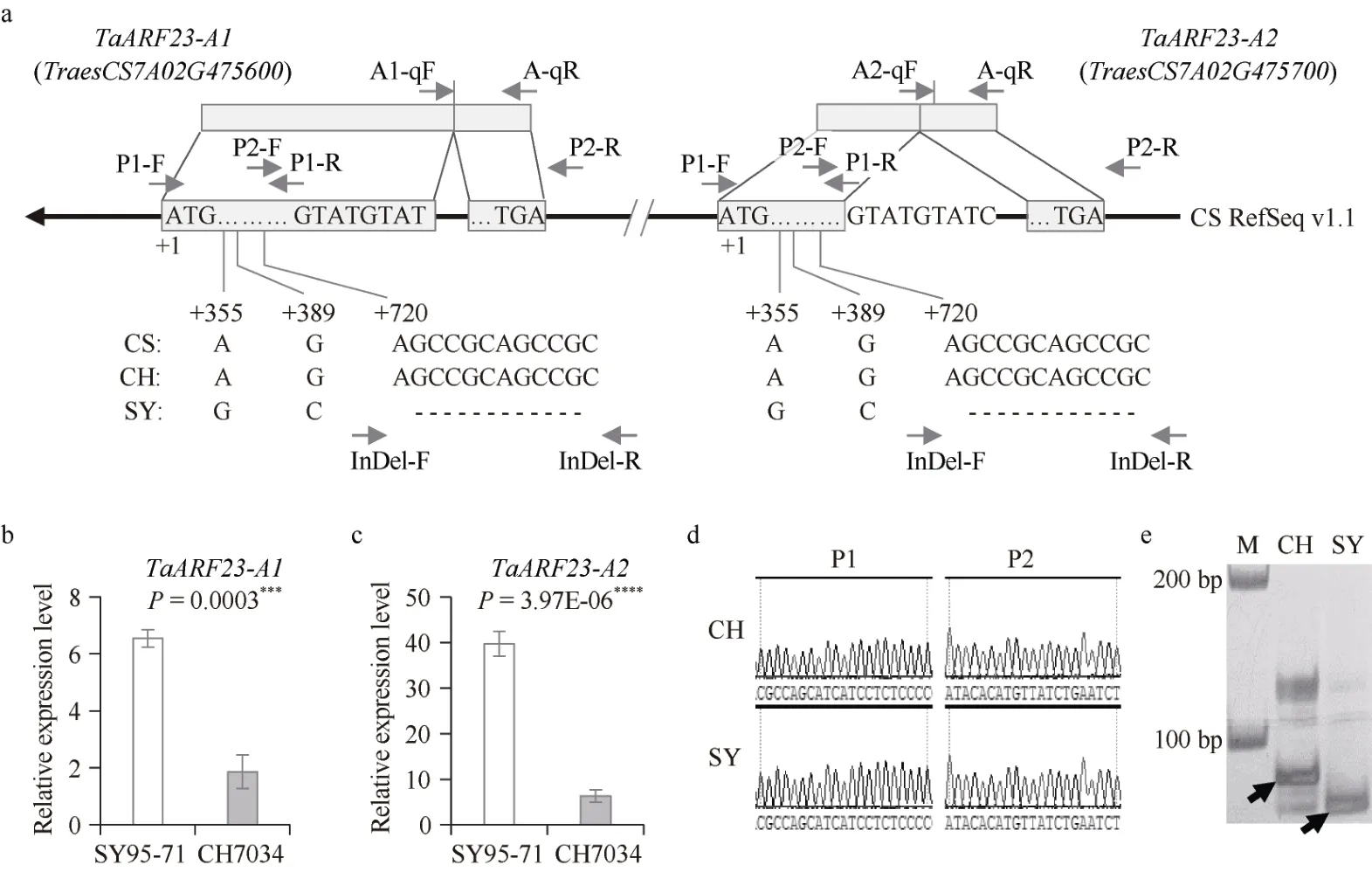
图5 TaARF23-A 分析Fig.5 Analysis of TaARF23-A
TaARF23-A1和TaARF23-A2在启动子区、外显子和内含子的序列完全相同, 但具有不同的转录本。与TaARF23-A1相比,TaARF23-A2的第1 个外显子在剪切过程中缺少了9 bp, 据此开发特异定量引物A1q 和A2q (图5-a)。qRT-PCR 结果表明, SY95-71 幼穗中TaARF23-A1和TaARF23-A2的表达量极显著高于CH7034 (图5-b~c), 与转录组测序结果一致。
2.5 TaARF23-A 与穗部表型的关联分析
基于中国春参考基因组, 我们设计了2 对引物P1 和P2 来扩增CH7034 和 SY95-71 中TaARF23-A基因组序列。测序结果显示, P1 和P2 的扩增产物均没有杂峰(图5-d),表明在 CH7034 或者 SY95-71 中,TaARF23-A1和TaARF23-A2也具有完全相同的基因组序列。
通过比对CH7034 和 SY95-71 中的TaARF23-A序列,在第一个外显子中鉴定到3 个多态性位点, 包括2 个SNP和1 个InDel (图5-a)。在InDel 位点, CH7034 具有12 bp的序列插入, SY95-71 中则缺失。据此开发了InDel 标记,该标记在CH7034 和SY95-71 中分别扩增出82 bp 和70 bp的条带(图5-e)。
利用InDel 标记鉴定CH7034 和SY95-71 的RILs 群体获得标记型, 将其与群体穗部表型进行关联分析, 结果显示(图6), 除了1 个环境(15L)以外, 该InDel 标记在其余5 个环境下与群体穗密度表型显著相关(P<0.05), 在所有环境数据平均值下呈极显著相关(P=5.57E-07); 进一步分析穗密度表型的2 个组分(穗长和小穗数), 发现InDel 标记与群体穗长不相关(P>0.05), 而与每穗小穗数呈极显著相关(P<0.0001), 表明TaARF23-A与小穗数相关。
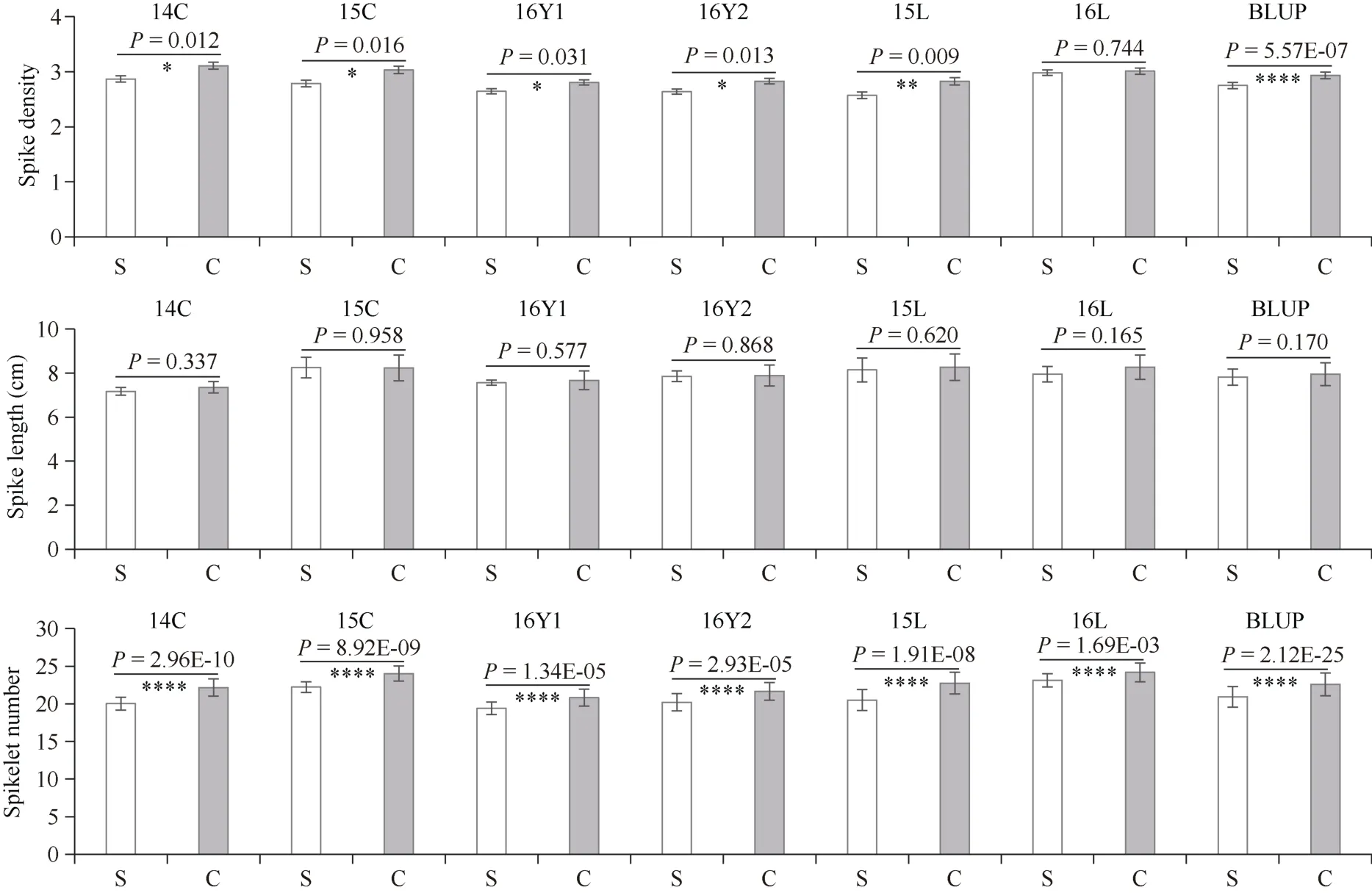
图6 RILs 群体中InDel 标记型与6 个环境下穗部表型的相关性分析Fig.6 Correlation analysis between genotypes of InDel marker and phenotypes of spike in RILs population under six environments
3 讨论
3.1 小麦穗型受生长素通路调控
生长素是调控小麦小穗发育的重要激素之一[1]。在本研究中, SY95-71 和CH7034 幼穗中的生长素主要由色胺途径合成, 并在SY95-71 中富集到了特有的、与生长素合成和代谢相关的高置信 GO 条目。与 CH7034 相比,SY95-71 幼穗中的色氨酸脱羧酶基因TDC具有更高的转录水平, 可将底物色氨酸转化为更高含量的色胺, 进而合成生长素。之后, 生长素通过TIR1/AFB 途径[15]激活ARF,后者进一步调控原初响应基因Aux/IAA、SAUR和GH3的表达, 最终形成与CH7034 不同的穗型。然而, 吲哚乙酸IAA 在SY95-71 和CH7034 幼穗中没有显著差异, 这可能是由于幼穗是合成生长素的主要器官, 对IAA 浓度极为敏感, 过多的IAA 通常会被向下运输到其他组织部位, 防止其对幼穗生长发育造成抑制, 并使植株保持一定程度的顶端优势[16-17]。另外, 信号传导通路也会对高浓度IAA产生负反馈机制, 如GH3编码的酰基酰胺合成酶可催化IAA 与氨基酸结合而失活, 从而动态调节IAA 的含量[18]。因此, 幼穗中生长素含量差异可能会以其前体色胺的形式来体现, 这个现象在一些研究中已有报道[19]。
3.2 TaARF23-A 与小穗数相关
通过穗型调控小穗数是优化小麦产量的重要策略[20-21]。迄今已有多个小穗数基因被报道, 如WFZP[22]、WAPO1[23]、FT-D1[24]、TaCOL-B5[25]和TaNAC67[26]等。本研究鉴定出1 个与小穗数极显著相关的生长素响应因子基因TaARF23-A。该基因包含2 个相邻的串联重复A1 和A2, 两者具有完全相同的基因组序列, 但转录本不同, A1和A2 的表达量在不同穗型间均差异显著。在小麦中, 某些基因经历串联重复事件后拷贝数增加, 对表型的调控能力会增强。如Rht-D1b经串联重复后获得2 个拷贝, 其降秆效应是单个拷贝的3 倍[27];TaCYP81D具有5 个串联拷贝, 该位点使植株对盐胁迫的耐受性增强[28]。因此,TaARF23-A1和TaARF23-A2的编码产物可能都参与了对小穗数的调控。
此外,TaARF23-A的外显子在SY95-71 和CH7034 间存在序列多态性, 根据InDel 位点开发了分子标记。在6个大田环境条件下,TaARF23-A的CH7034 型等位变异的小穗数为22.59, 比SY95-71 型等位变异(20.92)增加了1.67 个(P=2.12E-25)。该标记可用于育种工作中的种质筛选或分子辅助选择。
3.3 TaARF23-A 可能的调控机制
本研究中,TaARF23-A在SY95-71 中比CH7034 具有更高的表达水平, 但SY95-71 型等位变异对应的小穗数却较低, 可能的调控机制有2 个。一是TaARF23-A 为正向调控因子, 诱导了Aux/IAA 等抑制子的表达, 造成对小穗数的负调控, 例如启动子区包含ARF 结合元件AuxRE的TaIAA-3A(TraesCS3A02G108400)可能为抑制子(图7-a)。类似于 TaARF25-TaIAA21 模型, TaARF25 诱导TaIAA21表达, 但TaIAA21 负调控粒径和粒重[29]。二是TaARF23-A 为负向调控因子, 抑制了SAUR等基因的表达(图7-b)。SAUR 是生长素调控细胞生长的主要效应因子,saur19突变体的根部分生组织减少、侧根数目减少[30], 因此猜测穗部SAUR基因受抑制后也可能会造成小穗数目减少。通常认为当ARF 中间区域(middle region)的谷氨酰胺Q-丝氨酸S-亮氨酸L 含量较高时, ARF 激活靶基因; 当MR 的丝氨酸S-脯氨酸P-甘氨酸G 含量较高时, ARF 抑制靶基因[31]。TaARF23-A 的MR 区域(240~321 氨基酸)包含QSL 个数为18, SPG 个数为14, 其为正向调控因子的可能性较大。然而最新研究表明, ARF 对靶基因具有双重功能,在不同生长发育时期表现出特定的激活或抑制作用[32]。此外,TaARF23-A外显子中的3 处序列多态性造成的蛋白水平变异, 也可能对其功能产生影响。这些需要后续大量试验进行验证。
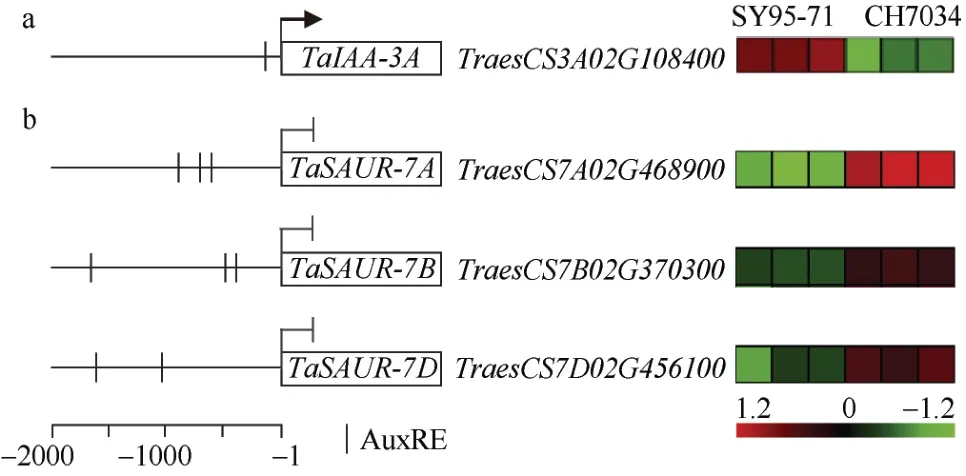
图7 TaARF23-A 的预测靶基因Fig.7 Predictive target genes for TaARF23-A
致谢: 电子科技大学杨足君教授、四川省农业科学院杨恩年研究员和山西农业大学郑军研究员在群体构建、大田种植以及表型鉴定方面给予了大力支持, 谨致谢忱!

