miR-485-5p靶向氧连接的N-乙酰氨基葡萄糖转移酶抑制前列腺癌细胞的增殖、迁移与侵袭
胡东来, 赵梓岐, 李 元, 杨 丽, 雷艳丽, 楚元奎, 3)*
(1)宁夏医科大学临床医学院检验学系, 银川 750004;2)宁夏医科大学基础医学院科研平台, 银川 750004;3)宁夏医科大学总医院医学实验中心, 银川 750004)
前列腺癌是男性生殖系统最常见的恶性肿瘤[1],雄激素剥夺疗法是转移性病例的主要治疗方法之一,然而,有相当一部分接受雄激素剥夺疗法治疗的患者最终却进展为更为恶性的去势抵抗性前列腺癌[2]。因此,探索前列腺癌发生发展的调控机制和寻找潜在的治疗靶点是目前亟待解决的问题之一。
微RNA(microRNAs,miRNAs)是长度约为21~24核苷酸的非编码RNA分子,其主要功能是通过靶向信使RNA(mRNA)转录物来调节基因表达和细胞的生物学过程[3]。研究表明,miR-485-5p通过靶向原癌基因酪氨酸蛋白激酶(Proto-oncogene tyrosine-protein kinase Src , SRC)在体内外抑制卵巢癌的进展[4]、通过靶向跨膜糖蛋白Mucin 1 (Transmembrane glycoprotein Mucin 1 , MUC1)抑制乳腺癌的进展[5],以及通过负向调控角蛋白17 (Keratin 17, KRT17)抑制口腔鳞状细胞癌的进展[6]。然而,miR-485-5p在前列腺癌中发挥的作用鲜有报道。因此,明确miR-485-5p在前列腺癌中所发挥的作用与机制,有助于了解前列腺癌发生发展的内在原因。
氧连接的N-乙酰氨基葡萄糖转移酶(O-linked N-acetylglucosamine transferase, OGT)属于多糖转移酶家族,在碳水化合物活性酶数据库中被分类为糖基转移酶41家族的成员[7],已报道OGT与癌症特异性细胞死亡之间存在显著相关性[8, 9]。由于其是细胞增殖所必需的,但细胞在有丝分裂后在无它的情况下也能存活,这使得该酶成为典型的癌症靶标[10]。OGT是一种参与癌细胞中氧非依赖性葡萄糖和谷氨酰胺消耗的酶,通过原癌基因MYC调节有丝分裂细胞代谢的相互作用而发展雄激素非依赖性前列腺癌,并在侵袭性前列腺癌中最常高表达[11]。先前的研究证实,在食管癌中,miR-485-5p通过靶向OGT抑制食管癌细胞增殖、迁移与侵袭[12],但miR-485-5p/OGT轴在前列腺癌中发挥的作用尚未报道,有待进一步研究。
鉴于此,本文旨在探究miR-485-5p是否靶向调控OGT从而影响前列腺癌细胞的增殖、迁移及侵袭,明确miR-485-5p/OGT轴在前列腺癌进展中所发挥的作用,以期为前列腺癌的靶向治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 前列腺癌细胞系PC3、DU145、LNCaP、22Rv1及正常前列腺上皮细胞RWPE-1均来源于中国科学院典型培养物保藏委员会细胞库(上海)。
1.1.2 RPMI 1640培养基、DMEM培养基(上海源培生物科技股份有限公司);特级胎牛血清(BI,以色列);LipofectamineTM2000(Invitrogen公司,美国);miR-485-5p mimics与inhibitor、mimics NC、 inhibitor NC、si-OGT、si-NC、含miR-485-5p结合位点的Wt-OGT和Mut-OGT荧光素酶表达载体(上海吉玛制药技术有限公司);mimics、inhibitor、si-OGT、及各NC序列详见Table 1;TRNzol Universal总RNA提取试剂盒(北京天根生化科技有限公司);双荧光素酶检测试剂盒(北京全式金生物生物技术股份有限公司);逆转录试剂盒、实时荧光定量PCR 试剂盒(南京诺唯赞生物科技股份有限公司);引物(上海生工生物工程股份有限公司)。GAPDH抗体(Proteintech公司;美国);OGT抗体(immunoway公司,美国);山羊抗兔 IgG-HRP、山羊抗鼠 IgG-HRP(Proteintech 公司,美国);全蛋白提取试剂盒、BCA 蛋白浓度检测试剂盒(江苏凯基生物技术股份有限公司)。
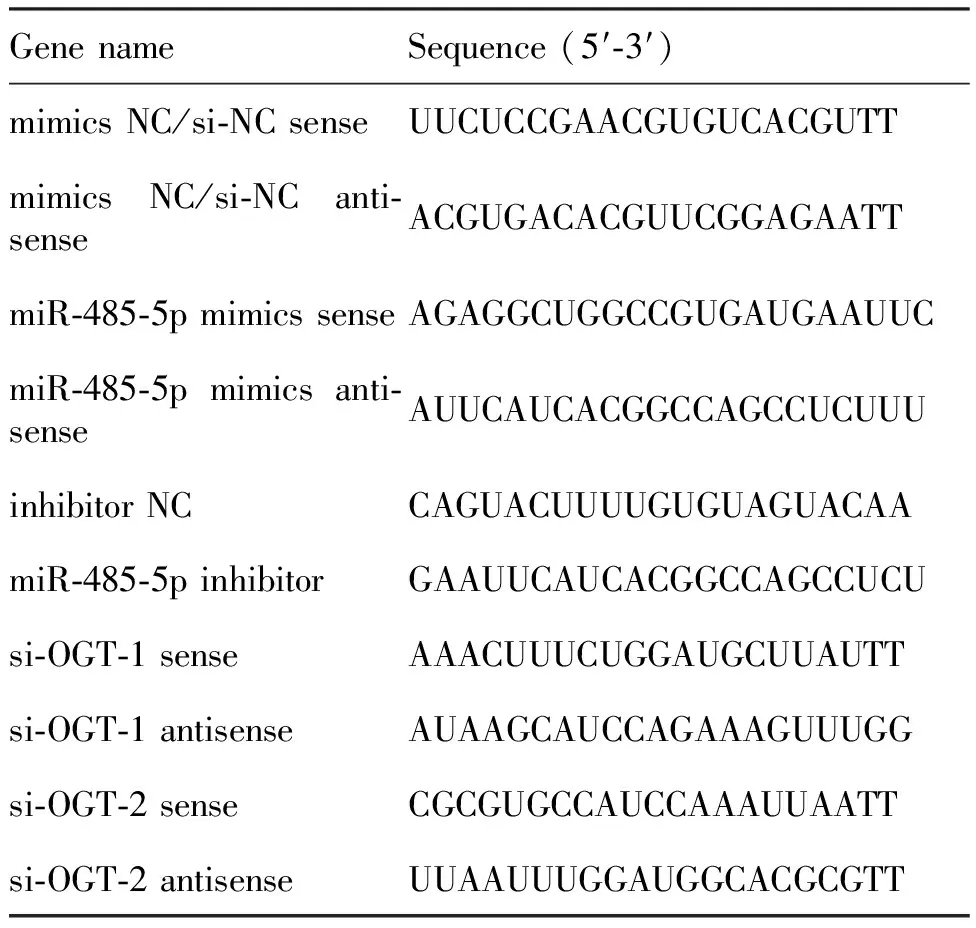
Table 1 Sequence
1.1.3 CO2恒温培养箱(Thermo Fisher Scientific,美国);倒置荧光显微镜(Olympus Corporation,日本);荧光定量PCR仪(Applied Biosystems ,美国);化学发光成像系统(GE通用电气,美国);电泳仪(Bio-rad,美国)。
1.2 方法
1.2.1 细胞培养与转染 DU145、PC3、LNCaP细胞用含10%胎牛血清的RPMI 1640培养基、22Rv1细胞用含10%胎牛血清的DMEM培养基、RWPE-1细胞用前列腺正常上皮细胞专用培养基培养,置于37 ℃、5% CO2培养箱中培养,隔天换液,待细胞生长汇合度达90%左右时进行传代。将对数生长期的细胞用胰酶消化、重悬后接种在六孔板中用于转染。当细胞生长汇合度达到50%~70%时,参考LipofectamineTM2000试剂说明书,分别将miR-485-5p mimics及inhibitor、si-OGT及对应NC转染到PC3和DU145细胞中,转染终浓度为50 nmol/L,培养24 h~48 h进行后续实验。
1.2.2 平板克隆形成实验 将转染48 h后的PC3和DU145细胞,消化后重悬成单个细胞悬液,于12孔板中铺板,再放置培养箱中继续培养,每3 d换液1次,培养9~14 d。PBS润洗细胞,用4%多聚甲醛进行固定,再用0.1%结晶紫水溶液染色,PBS润洗细胞,自然风干后计数细胞克隆数量,并计算克隆形成率。
1.2.3 划痕愈合实验 用0.25%胰蛋白酶消化处于对数生长期的PC3和DU145细胞,细胞重悬后,以3×105个/孔细胞数量铺于六孔板中,待细胞生长汇合度达50%~70%时进行转染。用1 mL吸头进行划痕,PBS洗去漂浮的细胞,分别在0 h、24 h拍照,记录划痕的宽度并计算细胞迁移率。
1.2.4 Transwell实验 以无血清培养基1∶8稀释Matrigel基质胶,侵袭实验组每个小室中垂直加入60 μL稀释好的基质胶,室温静置使基质胶充分凝固,迁移实验组的小室不铺胶。收集分组转染24 h后的细胞,即胰酶消化,用无血清培养基重悬,并接种在上室中,保持上室终体积为200 μL,下室加入700 μL含20%血清的完全培养基,放入培养箱中培养24 h。用4%多聚甲醛进行固定以及0.1%结晶紫水溶液加以染色、PBS润洗、棉签轻轻擦去小室底部上层细胞,室温风干,显微镜下拍小室底部下层的细胞图片,imageJ软件计数迁移与侵袭的细胞数量,分别计算迁移率和侵袭率,迁移率=[(迁移的细胞数)/(接种的细胞数)]×100%,侵袭率=[(侵袭的细胞数)/(接种的细胞数)]×100%。
1.2.5 双荧光素酶报告实验 构建含miR-485-5p结合位点的Wt-OGT和Mut-OGT荧光素酶表达载体(上海吉玛制药技术有限公司),取对数生长期的293T细胞进行铺板,将miR-485-5p mimics、 mimics nc、Wt-OGT、Mut-OGT分组共转染,24 h后收集细胞样品,具体参考TransDetect®Double-Luciferase Reporter Assay Kit 试剂盒(北京全式金生物生物技术股份有限公司)说明书进行荧光素酶活性的检测。
1.2.6 qRT-PCR 实验 Trizol 法提取各组总RNA,测浓度和纯度,确保浓度和纯度达标后,按照HiScript II Q RT SuperMix for qPCR和 ChamQ SYBR qPCR master Mix 试剂盒说明书(南京诺唯赞生物科技股份有限公司)进行反转录和qRT-PCR检测,引物序列详见Table 2。反应条件:95 ℃、5 min,95 ℃、15 s,58 ℃、15 s,72 ℃、15 s,设40个循环,以GAPDH、U6作为内参,2-ΔΔCt法计算各基因的相对表达量。
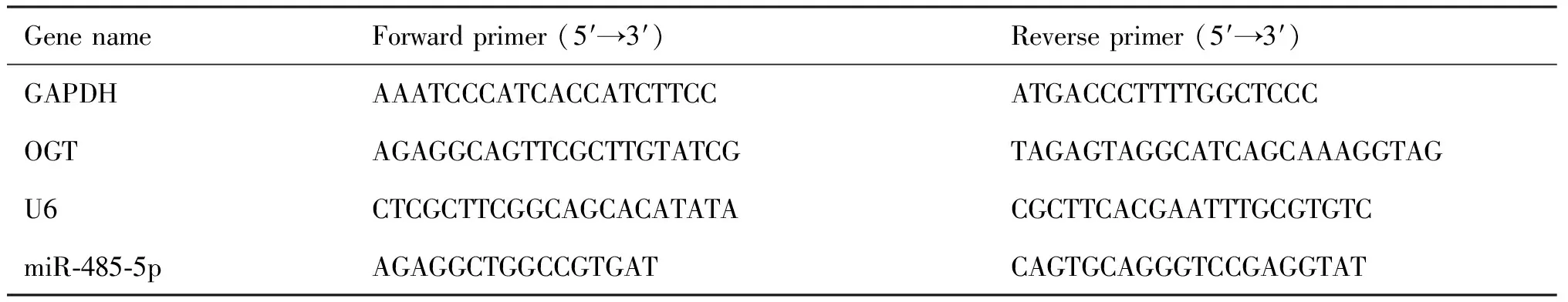
Table 2 Primer sequence of qRT-PCR
1.2.7 Western 印迹实验 各组细胞培养 48 h后,提取细胞总蛋白质,BCA法测其浓度,取20~30 μg蛋白质上样,SDS-PAGE 凝胶电泳分离蛋白质后,转印至PVDF膜上,用5% 脱脂牛奶于室温摇床封闭2~3 h,PBST每次10 min漂洗3次后,加入相应一抗,4 ℃孵育过夜,回收一抗,PBST漂洗3次后,加入二抗,室温孵育1 h,再次3次漂洗,加入ECL化学发光液显影,以GAPDH为内参进行统计学处理。
1.3 统计学分析
数据以平均数±标准差(means ±SD)方式表示,所有实验均生物学重复3次,采用SPSS.26及Graphad Prism 9.4.1 软件进行统计分析,两组间比较采用t检验,多组间比较采用方差分析,以双侧P<0.05表示差异具有统计学意义。
2 结果
2.1 miR-485-5p在前列腺癌中表达下调
借助dbDEMC网站 (biosino.org)现有数据集对前列腺癌中差异表达的miRNA进行预测,分析结果发现,与前列腺癌旁组织相比miR-485-5p在前列腺癌组织中低表达(P=1.16e-2,Fig.1A-B),并且经查阅文献得知,在前列腺癌中研究其表达、功能和作用机制的报道甚少,因此,选择相对新颖的miR-485-5p分子作进一步研究。通过qRT-PCR技术检测miR-485-5p在前列腺正常上皮细胞与癌细胞系中的表达差异,结果显示,与在前列腺正常上皮细胞RWPE-1中的表达量(1.00 ± 0.06)相比,miR-485-5p在PC3(0.35 ± 0.03)、DU145(0.38 ± 0.01)及LNCaP(0.42±0.05)细胞系中呈低表达,且差异具有统计学意义(P<0.01,Fig.1C),考虑到与LNCaP细胞相比,PC3和DU145细胞具有更强的增殖、迁移及侵袭能力,并且更能代表前列腺癌发展的晚期阶段,因此,在接下来的探索方面选择在PC3和DU145细胞中研究miR-485-5p的功能及相关调控机制。
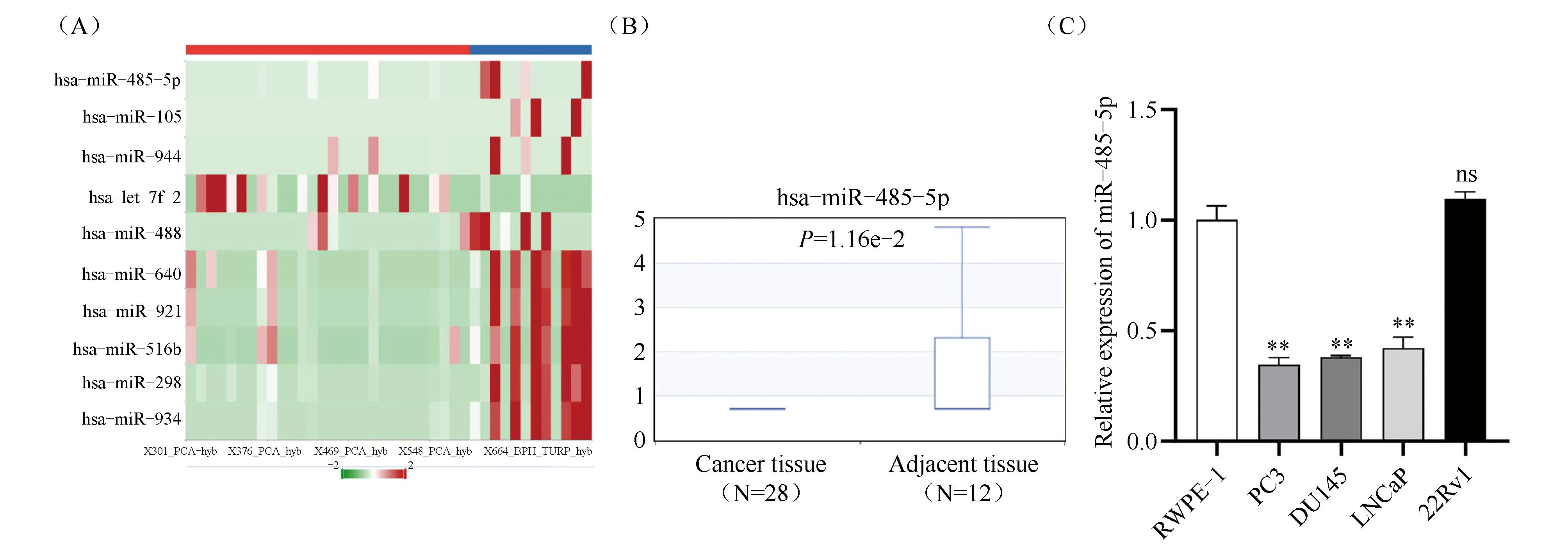
Fig.1 The expression of miR-485-5p in prostate cancer tissue and cells (A-B) Heat map analysis of miR-485-5p was performed in the dbDEMC website and its expression in prostate cancer tissues was analyzed. (C) The expression of miR-485-5p in prostate cancer cell lines was detected by qRT-PCR.**P<0.01. n=3
2.2 miR-485-5p抑制前列腺癌细胞的增殖、迁移与侵袭
采用qRT-PCR技术检测miR-485-5p在2种细胞中的转染效果,在PC3细胞中,与mimics NC组 (1.00 ± 0.09) 相比,miR-485-5p mimics组表达量显著上调(1.30 ± 0.07) ,在DU145细胞中,与mimics NC组(1.01 ± 0.12)相比,miR-485-5p mimics组表达量显著上调( (16.08 ± 0.13),差异具有统计学意义(P<0.05, Fig.2A-B)。通过平板克隆形成实验检测miR-485-5p对前列腺癌细胞增殖能力的影响,结果显示, PC3细胞中,与mimics NC组(100.00% ± 9.00%)相比,过表达miR-485-5p能够显著抑制PC3细胞的克隆形成率(59.33% ± 3.51%),DU145细胞中,与mimics NC组(100.30% ± 6.42%)相比,过表达miR-485-5p同样能够显著抑制DU145细胞的克隆形成率(71.0% ± 8.54%),差异具有统计学意义(P<0.01, Fig.2C-E)。采用Transwell实验检测miR-485-5p对前列腺癌细胞迁移和侵袭能力的影响,结果显示,PC3细胞中,分别与迁移的mimics NC组(99.00% ± 8.54%)和侵袭的mimics NC组(100.00% ± 9.00%)相比,过表达miR-485-5p能够显著抑制PC3细胞的迁移率(59.33% ± 6.51%)和侵袭率(44.67% ± 4.51%),DU145细胞中,分别与迁移的mimics NC组(100.00% ± 5.00%)和侵袭的mimics NC组(100.30% ± 10.02%)相比,过表达miR-485-5p同样能够抑制DU145细胞的迁移率(40.67% ± 4.73%)和侵袭率(36.00% ± 4.58%),差异具有统计学意义(P<0.01, Fig.2F-I)。同时,划痕愈合实验结果显示,与PC3细胞的mimics NC组(100.0%±11.27%)相比,过表达miR-485-5p显著抑制了PC3细胞的迁移率(54.67%±7.5%),与DU145细胞的mimics NC组(100.30% ±3.51%),过表达miR-485-5p同样是抑制了DU145细胞的迁移率(44.33% ± 2.08%),且差异具有统计学意义(P<0.01, Fig.2J-L)。综上所述,miR-485-5p抑制PC3和DU145细胞的增殖、迁移与侵袭。
2.3 miR-485-5p靶向调控氧连接的N-乙酰氨基葡萄糖转移酶
通过TargetScan、PITA、miRmap、miRDB、microT及PicTar网站预测miR-485-5p的靶基因,Venn图表明,OGT是这六款软件共同预测的待选靶基因之一(Fig.3A)。随后构建OGT3′UTR的野生型和突变型双荧光素酶报告载体,采用双荧光素酶报告检测验证miR-485-5p与OGT的靶向关系,结果显示,与mimics NC组(1.0±0.08)相比,miR-485-5p mimics使得OGT3 ′UTR-Wt组的荧光素酶活性显著降低(0.85 ± 0.30),而OGT3 ′UTR-Mut的荧光素酶活性无显著变化(0.96 ± 0.06),即:正如预测,两者具有结合位点(P<0.05,Fig.3B-C)。接着本文通过Western 印迹检测过表达miR-485-5p,OGT蛋白的表达量变化,结果显示,过表达miR-485-5p时,OGT蛋白的表达量显著下调(Fig.3D),同时采取qRT-PCR技术检测过表达miR-485-5p后OGTmRNA的表达量变化,与mimics NC组(1.00 ± 0.19)相比,过表达miR-485-5p后,OGTmRNA表达量显著下调(0.39 ± 0.01),差异具有统计学意义(P<0.01,Fig.3E)。上述结果表明,miR-485-5p能够与OGT靶向特异性结合,OGT是miR-485-5p的直接靶标。
2.4 氧连接的N-乙酰氨基葡萄糖转移酶在前列腺癌中表达上调
借助GEDS(http://bioinfo.life.hust.edu.cn/web/GEDS/)网站分析OGT在多种肿瘤中的表达情况,结果显示,其在前列腺癌、肺癌和肝癌等癌组织中高表达(Fig.4A)。利用GEPIA网站 (Gene Expression Profiling Interactive Analysis) (cancer-pku.cn)来分析OGT在前列腺癌组织中的表达,结果显示,与前列腺正常组织相比,OGT在癌组织中高表达(P<0.01,Fig.4B )。随后,采用qRT-PCR技术检测OGT在前列腺癌细胞系中的表达,与在前列腺正常上皮细胞RWPE-1中的表达量(1.01 ± 0.14)相比,OGT在PC3(19.10 ± 0.08)、DU145(3.89 ± 0.23)、LNCaP(19.17 ± 0.32)、22Rv1(3.55 ± 0.12)4种癌细胞系中均高表达(P<0.01,Fig.4C),提示其可能在前列腺癌的进展中发挥促癌作用。
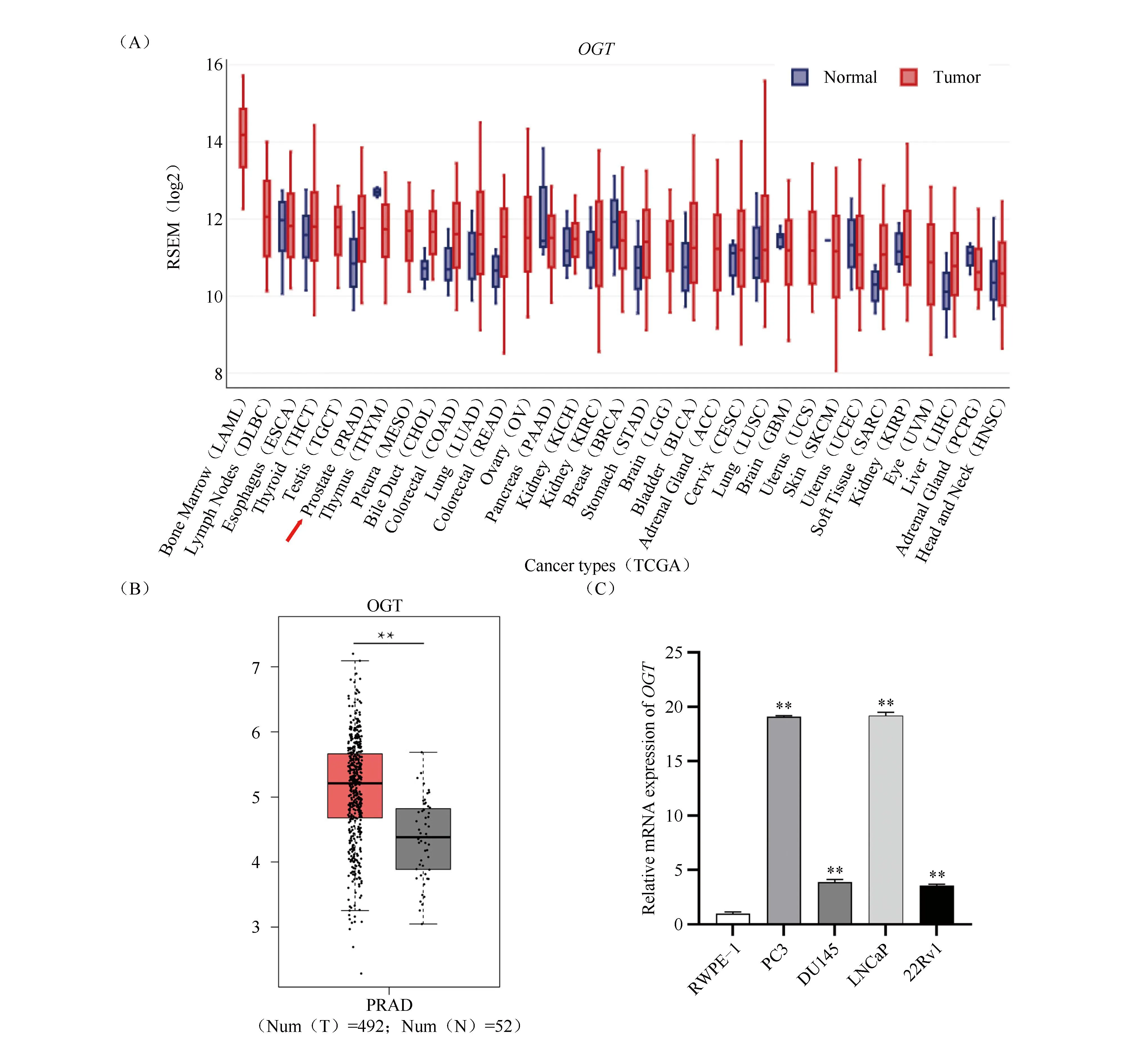
Fig.4 The expression of OGT in prostate cancer tissues and cells (A) The expression of OGT in tissues in various tumors was analyzed using the GEDS website. (B) The expression of OGT was analyzed in prostate cancer tissues via GEPIA website. **P<0.01. (C) The expression of OGT in prostate cancer cell lines was detected by qRT- PCR,**P<0.01, n=3
2.5 氧连接的N-乙酰氨基葡萄糖转移酶促进前列腺癌细胞的增殖、迁移与侵袭
采用qRT-PCR技术检测OGT在 mRNA水平的干扰效果,在PC3细胞中,与si-NC组(1.00 ± 0.10)相比,si-OGT-1的mRNA表达量下降至(0.26 ± 0.03),si-OGT-2的mRNA表达量下降至(0.36 ± 0.02),在DU145细胞中,与si-NC组相比(1.00 ± 0.03),si-OGT-1的mRNA表达量下降至(0.25 ± 0.01),si-OGT-2的mRNA表达量下降至(0.46 ± 0.07),差异均具有统计学意义(Fig.5A,P<0.01 )。采用Western印迹检测OGT在蛋白质水平的干扰效果,干扰OGT后,其蛋白质表达量显著下降(Fig.5B ),选择si-OGT-1用于后续实验。采用平板克隆形成实验检测干扰OGT对前列腺癌细胞增殖的影响,结果显示,PC3细胞中,与si-NC组(100.00% ± 7.94%)相比,干扰OGT能够显著抑制PC3细胞的克隆形成率(64.67% ± 6.51%),DU145细胞中,与si-NC组(100.30% ± 9.07%)相比,干扰OGT同样能够抑制DU145细胞的克隆形成率(50.67% ± 7.37%),差异均具有统计学意义(Fig.5C-D,P<0.01)。同时,通过Transwell实验检测干扰OGT对前列腺癌细胞迁移与侵袭的影响,结果显示,PC3细胞中, 与si-NC迁移组(100.30% ± 5.51%)相比,干扰OGT能够显著抑制PC3细胞的迁移率(64.67% ± 4.73%),与si-NC侵袭组(99.67% ± 6.43%)相比,干扰OGT能够显著抑制PC3细胞的侵袭率(42.00% ± 6.56%),DU145细胞中,与si-NC迁移组(99.67% ± 10.60%)相比,干扰OGT同样能够抑制DU145细胞的迁移率(45.33% ± 7.10%),与si-NC侵袭组(100.00% ± 7.00%)相比,干扰OGT同样能够抑制DU145细胞的侵袭率(53.33% ± 9.50%),差异均具有统计学意义(Fig.5E-H,P<0.01)。综上所述,OGT促进前列腺癌细胞的增殖、迁移与侵袭。

Fig.5 The effect of OGT interference on the proliferation and migration of prostate cancer cells (A) The interference efficiency of OGT at mRNA level was detected by qRT-PCR,**P<0.01, n=3. (B) The interference efficiency of OGT at protein level was detected by Western blotting. (C-D) The proliferation ability of PC3 and DU145 cells after interference with OGT was detected by plate clone formation assay. The bar graph indicated the clone formation rate,**P<0.01, n=3. (E-H) Transwell assay detected the migration and invasion ability of PC3 and DU145 cells after interference with OGT, and the scale was 50 μm. Bar charts showed relative mobility and invasion rate, respectively,**P<0.01, n=3
2.6 干扰氧连接的N-乙酰氨基葡萄糖转移酶能够部分逆转miR-485-5p对前列腺癌细胞增殖、迁移与侵袭的影响
采用qRT-PCR技术检测miR-485-5p的抑制表达效果,经转染的PC3细胞中,与inhibitor NC组(1.00±0.07)相比,miR-485-5p的表达量下降至(0.15 ± 0.02),差异具有统计学意义(Fig.6A,P<0.01)。DU145细胞中,与inhibitor NC组(1.00 ± 0.06)相比,miR-485-5p的表达量下降至(0.40 ± 0.08),差异具有统计学意义(Fig.6B,P<0.01)。平板克隆形成实验检测干扰OGT后,miR-485-5p对前列腺癌细胞增殖的影响,结果显示,PC3细胞中,与inhibitor NC+si-NC组(100.00% ± 3.73%)相比, miR-485-5p inhibitor+si-NC组克隆形成率显著升高(208.50% ± 11.53%),而miR-485-5p inhibitor+si-OGT组克隆形成率仅为(146.50% ± 10.16%),DU145细胞中, 与inhibitor NC+si-NC组(100.00% ± 14.78%)相比,miR-485-5p inhibitor+si-NC组克隆形成率显著升高(205.4%±11.44%),而miR-485-5p inhibitor+si-OGT组克隆形成率仅为(157.50% ± 8.88%),差异均具有统计学意义(Fig.6C-D,P<0.01)。采用Transwell实验验证干扰OGT后,miR-485-5p对前列腺癌细胞迁移与侵袭的影响,结果显示,PC3细胞中,与inhibitor NC+si-NC迁移组(100.00% ± 8.97%)相比,miR-485-5p inhibitor+si-NC组迁移率显著升高(221.80% ± 13.14%),而miR-485-5p inhibitor+si-OGT组迁移率仅为(143.20% ± 9.77%),DU145细胞中,与inhibitor NC+si-NC迁移组(100.00% ± 18.81%)相比,miR-485-5p inhibitor+si-NC组迁移率显著升高(245.90% ± 11.44%),而miR-485-5p inhibitor+si-OGT组迁移率仅为(158.10% ± 12.93%),差异均具有统计学意义(Fig.6E-F,P<0.01)。PC3细胞中,与inhibitor NC+si-NC侵袭组(100.00% ± 11.81%)相比,miR-485-5p inhibitor+si-NC组侵袭率显著升高(233.70% ± 15.92%),而miR-485-5p inhibitor+si-OGT组侵袭率仅为(151.50% ± 8.60%),DU145细胞中,与inhibitor NC+si-NC侵袭组(100.00% ± 9.80%)相比, miR-485-5p inhibitor+si-NC组侵袭率显著升高(260.90% ± 12.67%),而miR-485-5p inhibitor+si-OGT组侵袭率仅为(158.80% ± 12.12%),差异均具有统计学意义(Fig.6G-H,P<0.01)。上述结果表明,干扰OGT在一定程度上能够逆转miR-485-5p对前列腺癌细胞增殖、迁移与侵袭的影响。因此,miR-485-5p通过靶向调控OGT发挥着抑制前列腺癌细胞增殖、迁移与侵袭的作用。
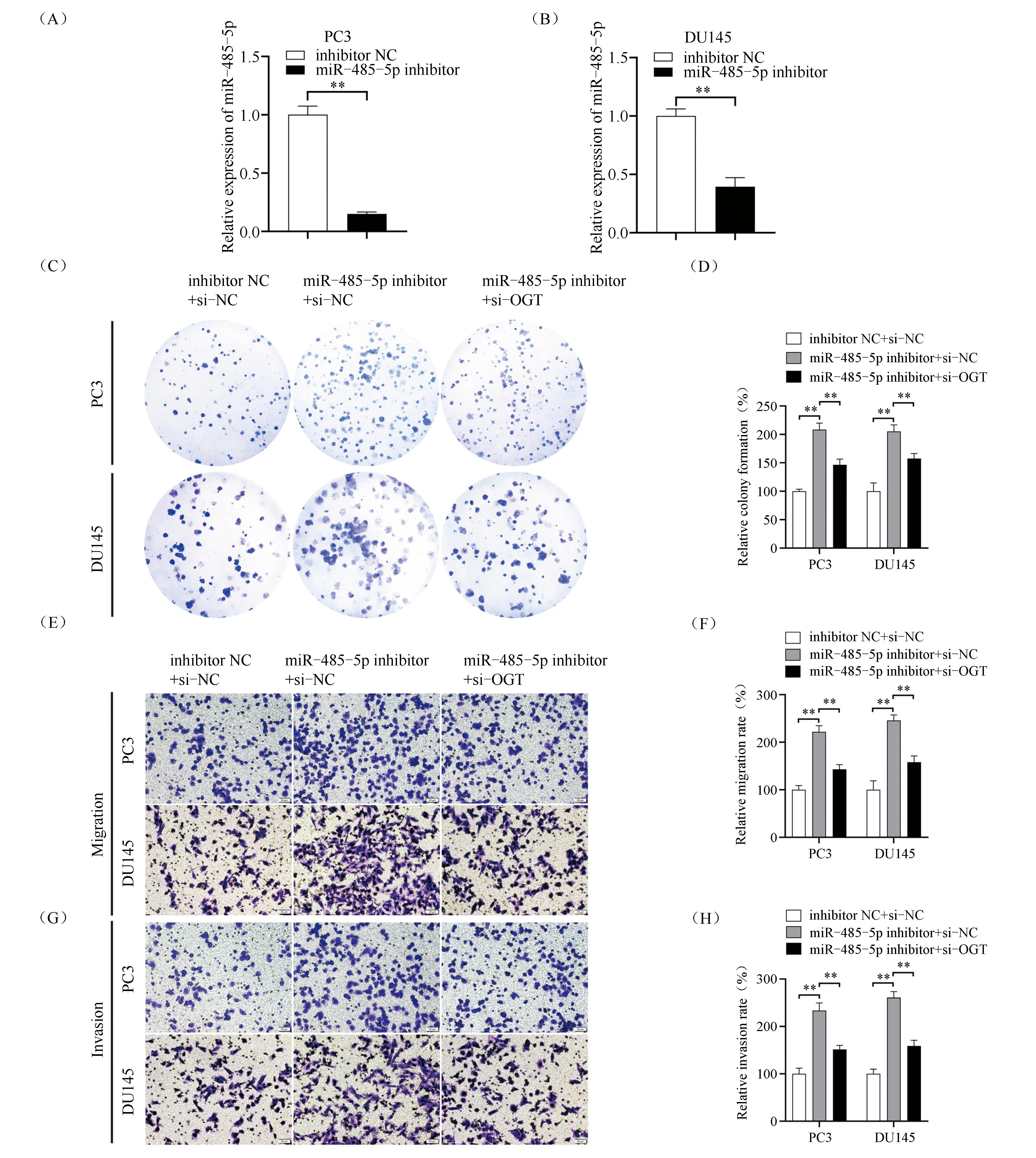
Fig.6 Verification of the interaction between miR-485-5p and OGT at the level of cell function (A) qRT-PCR verified the inhibitory expression efficiency of miR-485-5p in PC3 cells,**P<0.01, n=3. (B) qRT-PCR verified the inhibitory expression efficiency of miR-485-5p in DU145 cells,**P<0.01, n=3. (C-D) Plate clone formation assay was used to detect the proliferation ability of cells in each group. The bar graph indicated the clone formation rate,**P<0.01, n=3. (E-F) Transwell assay was used to detect the migration ability of cells in each group, and the scale was 50 μm. Bar graph showed the relative migration rate of cells,**P<0.01, n=3. (G-H) The invasion ability of cells in each group was detected by Transwell assay, and the scale was 50 μm. The bar graph showed the relative invasion rate of cells,**P<0.01, n=3
3 讨论
前列腺癌是美国男性癌症死亡的第二大原因[13], 在中国,前列腺癌的发病率近年来呈逐渐上升趋势[14]。毫无疑问,探索前列腺癌的发病机制及寻找有效的治疗靶点迫在眉睫。
越来越多的研究表明,许多癌症病例与miRNA失调相关。如:Zhao等人[15]研究表明,过表达miR-29a-3p或miR-29b-3p能够抑制乳腺癌细胞的增殖,Tang等人[16]研究显示,上调miR-21-5p能够促进肺癌细胞增殖、迁移与侵袭。就前列腺癌而言,已报道miR-205和miR-34a参与前列腺癌的进展并用作前列腺癌的潜在生物标志物或治疗靶标[17]。众所周知,miRNA可充当肿瘤抑癌基因或癌基因角色,既往研究表明miR-485-5p在许多肿瘤中扮演着抑癌基因角色,如:Yuqin Pan等人[18]的研究证实,过表达miR-485-5p可抑制结直肠癌细胞的增殖和侵袭,Zhao等人[19]研究显示,转染miR-485-5p inhibitor可促进肝癌细胞的增殖、迁移与侵袭。然而,miR-485-5p在前列腺癌中的作用仍未可知,因此,本文旨在探究miR-485-5p在前列腺癌中的作用和机制。
本文通过生物信息学分析发现miR-485-5p在前列腺癌组织中低表达,qRT-PCR实验证实其在前列腺癌PC3、DU145及LNCaP细胞系中均低表达,过表达miR-485-5p发现,PC3和DU145细胞的增殖、迁移与侵袭能力受到了显著抑制。众所周知,miRNA具有较为广泛的生物学调节功能,可通过直接结合信使RNA的3'非翻译区而调控基因的表达,为明确miR-485-5p抑制前列腺癌细胞增殖、迁移和侵袭的作用机制,本文借助靶向预测网站分析miR-485-5p的下游靶标,发现OGT是其中之一,另外,经查阅文献得知OGT在前列腺癌中表达上调[11, 20, 21],且较高的OGT表达与Gleason评分、pN分期和神经周围侵袭显著相关,提示OGT是晚期前列腺癌的潜在预后标志物[22]。随后,本文通过双荧光素酶报告、Western 印迹和qRT-PCR证实OGT是miR-485-5p的一个下游靶基因,后续实验证明,干扰OGT能够显著抑制前列腺癌细胞的增殖、迁移和侵袭,从而证实了OGT在前列腺癌中发挥的促癌作用,因此,本文推测miR-485-5p可以通过靶向结合OGT的mRNA进而发挥抑癌的生物学效应。共转染实验结果显示,干扰OGT能够在一定程度上逆转下调miR-485-5p对前列腺癌细胞增殖、迁移与侵袭的促进作用,从而证实miR-485-5p通过负向调控OGT发挥着抑癌作用。不足之处是本文只是在细胞水平做了研究,进一步的研究需要建立裸鼠模型来深入探究miR-485-5p的作用及调控机制,这将是今后继续研究的方向之一。
综上所述,本研究证实了miR-485-5p在前列腺癌细胞中的表达和生物学功能,并初步明确miR-485-5p可通过靶向调控OGT进而抑制前列腺癌细胞的增殖、迁移与侵袭。上述研究结果将有助于进一步揭示miR-485-5p在前列腺癌发生发展中的作用和机制,可为寻找前列腺癌的治疗靶点提供实验依据。

