卵巢细胞系糖脂代谢紊乱模型的构建及机制探索
孙亚群, 彭庆杰, 王强强, 苏亚珊,2, 陈科明,, 李广永, 吴 际, 何 瑞
(1.宁夏医科大学生育力保持教育部重点实验室,银川 750004; 2.宁夏医科大学基础医学院,银川 750004;3.宁夏医科大学总医院泌尿外科,银川 750004)
肥胖症、2 型糖尿病等代谢紊乱性疾病是严重威胁人类健康的重要问题,越来越多的证据[1-4]表明,代谢紊乱与不孕症密切相关,影响着全世界约10%的育龄夫妇。由于下丘脑-垂体-卵巢轴的失调,肥胖女性比正常体质量的女性更容易发生排卵障碍[5-6],引起内分泌紊乱及不孕。多囊卵巢综合征是典型代谢内分泌紊乱与生殖内分泌紊乱进而影响卵巢功能的疾病。卵巢的主要功能包括卵泡发育,卵母细胞的产生、成熟和释放,以及调节生殖和非生殖功能的雌性激素和肽激素的合成[7]。在糖尿病-肥胖综合征及多囊卵巢综合征中,进行性高血糖-高胰岛素血症与周期性卵巢卵泡募集模式的抑制、无排卵、无周期性、卵巢类固醇激素合成和释放抑制、血管减少和组织缺血、卵泡闭锁增强以及组织过早萎缩和退化有关[8-9]。糖脂代谢紊乱可以引起卵巢微环境改变,影响卵巢细胞功能,进而影响卵巢功能。已有研究[8-9]发现,肥胖和高血糖患者卵巢细胞退化可能与糖毒性和进行性细胞脂毒性作用的存在有关,但目前缺乏代谢紊乱相关的卵巢细胞模型,具体机制尚不清楚。本研究通过在中国仓鼠卵巢细胞(Chinese hamster ovary cells,CHO 细胞)的培养液中加入葡萄糖及油酸,模拟肥胖2 型糖尿病患者高糖高脂的代谢紊乱微环境,建立CHO细胞代谢紊乱损伤模型,并初步探讨其机制,为代谢紊乱损伤卵巢功能的研究提供新思路。
1 材料与方法
1.1 实验细胞
CHO 细胞(公认的卵巢细胞系)购自BNCC公司。将CHO 细胞传代于含10%胎牛血清、1%双抗的DMEM/F-12 培养基,置于含5% CO2、37 ℃恒温培养箱中培养。
1.2 主要试剂
DMEM/F-12 培养基(货号SH30023.01)购于HyClone 公司;彩色蛋白Marker、蛋白上样缓冲液、蛋白酶抑制剂、RIPA 裂解液购于上海雅酶生物医药科技有限公司;BCA 蛋白浓度测定试剂盒、苏木素-伊红染色液购于上海碧云天生物技术有限公司;CCK-8 试剂盒购于索莱宝生物科技有限公司;油酸(货号O1383)购于Sigma 公司;DMEM高糖培养基(货号SH30022.01)购于HyClone 公司;p-mTOR 一抗(货号2971)、哺乳动物雷帕霉素靶蛋白(mTOR)一抗(货号2983)、p-AMPK 一抗(货号2535)、AMPK 一抗(货号2532)、Caspase-3 一抗(货号9662)购于Cell Signaling Technology公司;PCNA 一抗(货号ab18197)购于Abcam 公司;β-actin 一抗(货号sc-47778)购于Senta Cruz Biotechnology 公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗兔IgG 免疫荧光二抗(货号A23220)购于Abbkine 公司。
1.3 仪器与设备
Multiskan GO 酶标仪(美国Thermo Fisher Scientific 公司)、超净工作台(苏州安泰空气技术有限公司)、荧光倒置显微镜(德国Bresser 公司)、高速台式离心机(上海力申科学仪器有限公司)、CO2培养箱(上海力申科学仪器有限公司)、GelDoc XR+凝胶成像分析系统、165-8001 型垂直电泳槽(美国Bio-Rad 公司)。
1.4 溶液配制
油酸溶液:量取9.7 μL 油酸置于1.5 mL 的EP 管中,打开盖子并放在超净台中,用紫外线灯照射消毒约30 min,然后加入40 μL 已消毒的DMSO 溶液,振荡使其充分溶解,即为备用的62.5 μmol·L-1油酸[10]母液。在造模前,先用50 mL的DMEM/F-12(含有1%双抗、10%胎牛血清)来稀释上面的母液至造模所需的相应浓度,放于4 ℃保存。高糖培养基:用44.5 mL DMEM 高糖培养基,加入0.45 mL 双抗、4.5 mL 胎牛血清,放于4 ℃保存。高糖高油酸溶液:用50 mL 的DMEM高糖培养基稀释高油酸的母液至造模所需的相应浓度,放于4 ℃保存。本实验采用25 mmol·L-1的葡萄糖[11-12]和62.5 μmol·L-1的油酸干预细胞建立代谢紊乱细胞模型,所用试剂及浓度均参照课题组前期实验,并参考文献[10-12]。
1.5 细胞分组与实验方法
1.5.1 CCK-8 实验 用DMEM/F-12 培养基培养CHO 细胞,将培养皿中覆盖率达80%~90%细胞离心收集,对细胞混悬液进行计数,按每孔100 μL 接种于96 孔板,每组设4 个复孔,5×103个/孔,并把培养板放置在37 ℃、5%CO2培养箱中孵育,在倒置显微镜下观察,观察CHO 细胞的贴壁及其生长状况。待细胞增殖铺满每孔的60%后,弃上清液并用无血清DMEM/F-12 培养基干预,给予饥饿处理4 h。磷酸盐缓冲液(PBS)清洗细胞2 次,于每孔再分别滴加相应的培养基[对照组(C 组):DMEM/F-12 培养基,单独高油酸模型组(O 组):62.5 μmol·L-1油酸的DMEM/F-12 培养基,单独高糖模型组(G 组):25 mmol·L-1的DMEM高糖培养基,高糖高油酸联合模型组(GO组):25 mmol·L-1DMEM 高糖培养基与62.5 μmol·L-1油酸],然后继续孵育24 h 后按照试剂盒说明每一孔滴加10 μL 的CCK-8 检测液,并在37 ℃的条件下孵育2 h,在读数之前放置摇床上,低速振荡缓慢混合均匀。在酶标仪450 nm 处测量其各孔的相应光密度(OD)值,实验重复3 次,计算细胞增殖率。细胞增殖率(%)=[(实验孔OD值-空白孔OD 值)(/对照孔OD值-空白孔OD值)]×100%;空白孔:CCK-8、培养基,对照孔:CCK-8、培养基、细胞,实验孔:CCK-8、培养基、细胞、受试化合物。进行以上4 组细胞活力检测。选取对细胞存活抑制最强的高糖高油酸联合模型组进行进一步的细胞活力检测以及细胞免疫荧光染色。
1.5.2 HE 染色实验 取5×103个/孔细胞混悬液,按每孔1 mL 接种于含有细胞爬片的24 孔板中培养,在倒置显微镜下进行观察。待细胞增殖铺满每孔的60%后,弃上清液并用无血清DMEM/F-12 培养基干预,给予饥饿处理4 h。PBS 清洗细胞2 次,于每孔再分别滴加相应的培养基(C 组:DMEM/F-12 培养基,O 组:62.5 μmol·L-1油酸的DMEM/F-12 培养基,G 组:25 mmol·L-1的DMEM 高糖培养基,GO 组:25 mmol·L-1DMEM高糖培养基与62.5 μmol·L-1油酸),每组设3 个复孔,然后继续孵育24 h 后弃上清液,PBS 清洗细胞3 次,加入4%多聚甲醛固定20 min 后再用PBS 清洗细胞3 次。苏木素加入24 孔板5 min,流水冲洗1 min,分化液分化1 s,水洗1 min,显微镜下观察染核情况。伊红加入24 孔板2 min,梯度乙醇脱水各10 s,二甲苯Ⅰ5 min,二甲苯Ⅱ5 min,中性树脂封片,显微镜镜检,图像采集分析。
1.5.3 细胞免疫荧光染色实验 取5×103个/孔细胞混悬液,按每孔1 mL 接种于含有细胞爬片的24 孔板中培养,在倒置显微镜下进行观察。待细胞增殖铺满每孔的60%后,弃上清液并用无血清DMEM/F-12 培养基干预,给予饥饿处理4 h。PBS 清洗细胞2 次,于每孔再分别滴加相应的培养基(C 组:DMEM/F-12 培养基,O 组:62.5 μmol·L-1油酸的DMEM/F-12 培养基,G 组:25 mmol·L-1的DMEM 高糖培养基,GO 组:25 mmol·L-1DMEM高糖培养基与62.5 μmol·L-1油酸),每组设3 个复孔,然后继续孵育24 h 后弃上清液,PBS 清洗细胞3 次,加入4%多聚甲醛固定20 min 后再用PBS 清洗细胞3 次。0.5% Triton X-100 处理细胞5 min,PBS 清洗细胞3 次,每次3 min。正常山羊血清室温封闭30 min 后,一抗4 ℃孵育过夜,PBS清洗细胞3 次,每次3 min。荧光标记二抗室温湿盒避光孵育1 h,PBS 清洗细胞3 次,每次3 min。DAPI 室温湿盒避光孵育5 min,PBS 清洗5 min,无菌水洗2 次,每次5 min。最后用含DAPI 的抗荧光淬灭剂封片,然后在荧光显微镜下观察采集图像。
1.5.4 Western blot 实验 取5×103个/孔细胞混悬液,按每孔2 mL 接种于6 孔板中培养,在倒置显微镜下进行观察。待细胞增殖铺满每孔的60%后,弃上清液并用无血清DMEM/F-12 培养基干预,给予饥饿处理4 h。PBS 清洗细胞2 次,于每孔再分别滴加相应的培养基(C 组:DMEM/F-12培养基,O 组:62.5 μmol·L-1油酸的DMEM/F-12培养基,G 组:25 mmol·L-1的DMEM 高糖培养基,GO 组:25 mmol·L-1DMEM 高糖培养基与62.5 μmol·L-1油酸),每组设3 个复孔,然后继续孵育24 h 后弃上清液,PBS 清洗细胞3 次,提取细胞总蛋白,加细胞裂解液(RIPA∶PMSF=1∶50),置于冰上裂解,离心分离上清液,采用BCA 法对蛋白浓度定量,蛋白变性后分装于EP 管中,保存备用;蛋白上样每孔40 μg 总蛋白,电泳(80 V 分离胶,100 V 浓缩胶)至溴酚蓝完全跑出,采用湿转法恒流200 mA 冰浴转膜,将蛋白移至PVDF 膜上;5%脱脂奶粉封闭膜2 h;4 ℃摇床孵育一抗过夜,避光常温孵育二抗(1:2 000)2 h,显色剂显色后,凝胶成像仪拍照,测灰度值,实验独立重复3 次。Image Lab 软件进行条带灰度值分析。以β-actin 为内参,计算蛋白相对表达量。
1.6 统计学方法
采用SPSS 19.0 统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,多个样本组间比较采用方差分析;两组间比较采用独立样本t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 高油酸、高糖以及高糖高油酸处理对CHO细胞形态、数量及增殖的影响
高油酸、高糖以及高糖高油酸联合干预细胞24 h 后,HE 染色显示,与C 组比较,CHO 细胞形态出现变化:O 组细胞呈现两种形态,一部分细胞进一步拉长,呈现细长梭形,另一部分细胞收缩变圆,呈现圆球形;G 组以及GO 组细胞几乎全部变圆,相邻细胞间隙增大。CCK-8 实验结果显示,与C 组比较,O 组、G 组以及GO 组CHO细胞数量均减少(P 均<0.05)。待细胞增殖铺满每孔的60%后,给予无血清DMEM/F-12 培养基饥饿处理4 h,之后给予细胞高油酸、高糖以及高糖高油酸联合处理24 h,细胞增殖率分别为91.94%、53.02%、45.59%,均低于C 组(99.98%,P 均<0.05),与C 组相比,高糖高油酸联合处理24、36 和48 h时均可降低细胞增殖率(P 均<0.05),细胞增殖率降低达到50%,故认为高糖高油酸联合作用24 h 为最佳处理时间,见图1。
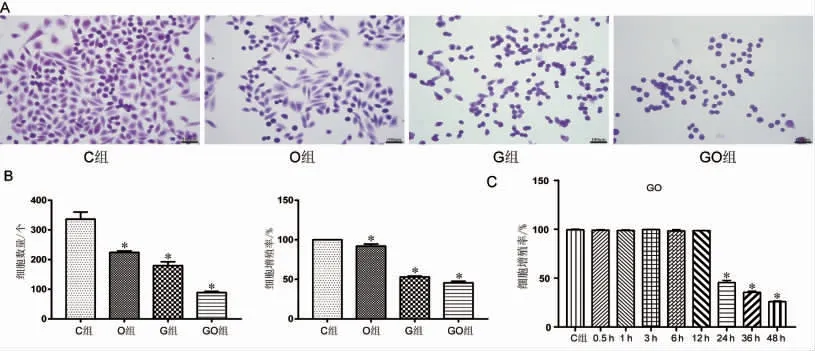
图1 各组CHO 细胞形态、数量及增殖的变化
2.2 Western blot 检测高油酸、高糖以及高糖高油酸处理对CHO 细胞半胱氨酸-天冬氨酸蛋白酶-3(Caspase-3)、增殖细胞核抗原(PCNA)蛋白表达的影响
与C 组相比,O 组、G 组以及GO 组CHO 细胞Caspase-3 蛋白表达水平均升高(P 均<0.05);与C组相比,G 组以及GO 组CHO 细胞PCNA 的蛋白表达水平均降低(P 均<0.05),见图2。

图2 各组CHO 细胞Caspase-3、PCNA 的蛋白表达及定量分析
2.3 高油酸、高糖以及高糖高油酸处理对CHO细胞p-mTOR、p-AMPK 表达的影响
与C 组相比,高油酸、高糖以及高糖高油酸处理后,G 组CHO 细胞p-mTOR 蛋白表达水平升高(P 均<0.05);与C 组相比,O 组、G 组以及GO组CHO 细胞p-AMPK 的蛋白相对表达水平均降低(P 均<0.05),见图3。
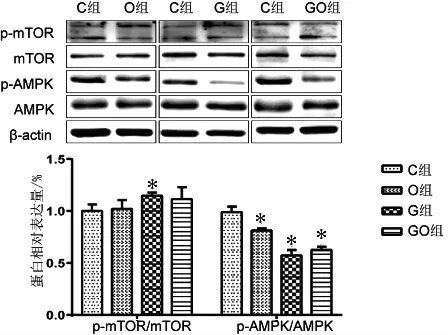
图3 各组CHO 细胞p-mTOR、p-AMPK 的蛋白表达及定量分析
2.4 细胞免疫荧光染色检测高糖高油酸处理对CHO 细胞Caspase-3、PCNA 表达的影响
细胞免疫荧光染色对高糖高油酸联合处理的CHO 细胞进行Caspase-3 凋亡以及PCNA 增殖鉴定结果显示,绿色荧光标记的细胞为Caspase-3 以及PCNA 阳性表达的细胞,蓝色荧光区域为DAPI。与C 组相比,GO 组Caspase-3 表达增加,PCNA 表达减少(P 均<0.05),且细胞核发生固缩,荧光显示不均匀,见图4。
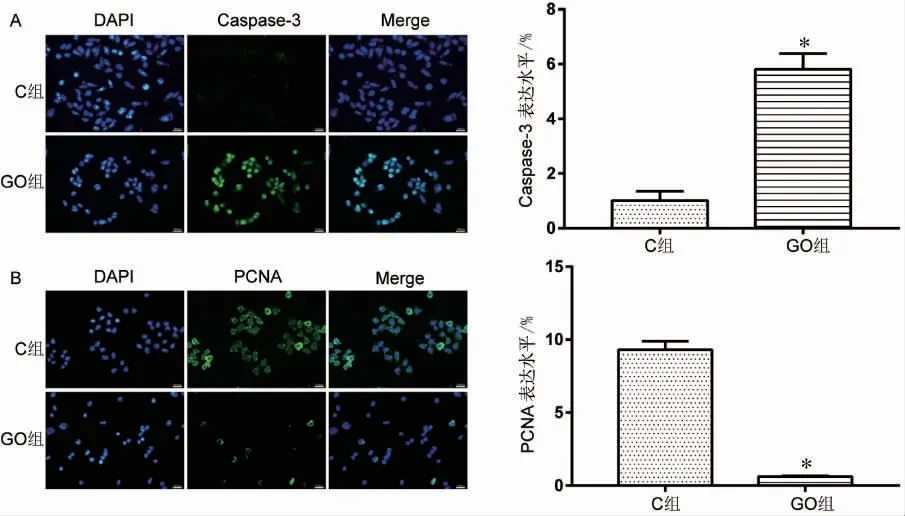
图4 高糖高油酸联合处理CHO 细胞Caspase-3、PCNA 蛋白的免疫荧光染色及定量分析
3 讨论
已有研究[13]发现,肥胖、糖尿病患者卵巢功能受损,高糖高油酸环境诱导卵巢细胞过度凋亡,早期阶段闭锁卵泡数量增加并且卵泡发育迟缓,打破了细胞增殖和凋亡之间的平衡,导致卵泡发育异常和卵巢功能衰竭。短期和长期高血糖对发育中的排卵前卵母细胞有影响,导致周围细胞凋亡增加、外源性凋亡途径上调[14]。此外,糖尿病通过诱导卵巢细胞凋亡和抑制卵巢血管生成触发卵巢功能异常[15],但具体机制尚不清楚。因目前缺乏体内高糖高油酸微环境的模型,因此,本研究利用高糖高油酸处理卵巢细胞系CHO 细胞,研究高糖高油酸微环境对CHO 细胞作用及机制,并建立模拟肥胖糖尿病所致CHO 细胞高糖高油酸微环境的体外模型。
通过高油酸、高糖及高糖高油酸联合处理体外培养的CHO 细胞,以高油酸处理诱发脂代谢紊乱微环境,以高糖培养基处理诱发糖代谢紊乱微环境,以及高糖高油酸联合处理诱发糖脂代谢紊乱微环境,实验结果显示,高糖、高油酸及联合状态下CHO 细胞数量均变少,细胞存活率降低,但是单独高油酸效果不如高糖及高糖与高油酸联合明显,说明糖代谢紊乱相比较脂代谢紊乱,对CHO 细胞影响更大,而高糖高油酸联合对CHO细胞影响最为明显,细胞过度凋亡,且增殖减少,与研究[13]报道的肥胖、糖尿病患者体内卵巢细胞增殖与凋亡失衡相一致。因此认为通过在培养基中加入葡萄糖和油酸,造成高糖高油酸微环境,可以成功建立模拟肥胖2 型糖尿病患者糖脂代谢紊乱的体内微环境的卵巢细胞模型。为进一步探究机制,检测高油酸、高糖及高糖高油酸联合处理卵巢细胞系CHO 细胞过程中细胞凋亡相关基因(Caspase-3)和PCNA 的表达。有研究[16]认为,Caspase-3 在Caspase 介导的细胞凋亡中充当执行者,Caspase-3 的表达与细胞的凋亡率呈正相关,PCNA 是细胞增殖早期事件的敏感标记物。本研究结果显示,高油酸、高糖及高糖高油酸联合处理后Caspase-3 表达增加,PCNA 表达降低,意味着细胞凋亡增加,而增殖减少。相比较高油酸所模拟的高脂环境,高糖更容易对CHO 细胞产生影响,而高糖和高油酸联合处理24 h 造成的糖脂代谢紊乱,对CHO 卵巢细胞的影响更明显,也最符合肥胖伴有2 型糖尿病的糖脂代谢紊乱机体微环境。
AMPK-mTOR 是能量代谢的经典信号通路,与生殖密切相关[17],为进一步探寻高糖高油酸微环境影响卵巢细胞系CHO 细胞的作用机制,本研究对AMPK-mTOR 信号通路进行研究。腺苷酸活化蛋白激酶(AMPK)是能量代谢、细胞生长和自噬的重要调节剂,同时也是能量稳态的外周和中枢调节剂,参与脂质、蛋白质和碳水化合物代谢[18]。肥胖症、2 型糖尿病和代谢综合征是能量平衡障碍,AMPK 对细胞和全身水平进行调节[19]。作为细胞和全身代谢的调节者,AMPK 已经成为治疗代谢紊乱(如肥胖病和2 型糖尿病)的靶点[20]。在糖尿病和肥胖症的几种啮齿动物模型中,AMPK 的药理学激活导致多种代谢途径的重塑,并导致疾病结果的实质性改善[21-25]。AMPK 与卵泡发育息息相关,研究[26-28]报道,不同物种的卵母细胞的不同细胞类型(卵母细胞、卵丘细胞、颗粒细胞和卵泡膜细胞)和黄体中鉴定出AMPK。mTOR是一种细胞质丝氨酸/苏氨酸蛋白激酶,属于磷酸肌醇3-激酶、PI3K 相关激酶家族,是细胞代谢、生长、增殖和存活的中心调节剂。研究表明,AMPK 信号通路的失调与代谢综合征等疾病状态有关[29],高葡萄糖水平[30]以及过量饱和的脂肪酸[31-33]可抑制AMPK;mTOR 可被营养物质(葡萄糖、氨基酸和脂质)、生长因子、胰岛素和炎性细胞因子激活[34-35]。本研究结果显示,高糖高油酸可抑制AMPK 的表达并激活mTOR,可能是高糖高油酸调控CHO 细胞增殖和凋亡的重要途径。
综上所述,本研究通过在体外培养卵巢细胞系CHO 细胞时给予过量葡萄糖和油酸,模拟肥胖病、糖尿病、多囊卵巢综合征等疾病造成的卵巢细胞系糖脂代谢紊乱微环境,并初步探讨其导致细胞损伤的机制,为肥胖病、糖尿病、多囊卵巢综合征等代谢紊乱性疾病卵巢损伤的研究提供了良好的体外细胞模型,并为代谢紊乱与生殖的相关机制研究提供了新的方法。

